
【题目】化学平衡主要研究下列哪一类反应的规律( )
A. 可逆反应 B. 任何反应 C. 溶液间反应 D. 气体间反应
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.2molNO2和0.3molNO,下列说法正确的是
A. 反应后生成的盐只有Fe(NO3)3
B. 反应后生成的盐只有Fe(NO3)2
C. 反应后生成的盐为Fe(NO3)2和Fe(NO3)3,其物质的量之比为1:3
D. 反应后生成的盐为Fe(NO3)2和Fe(NO3)3,其物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.

(1)该浓盐酸中HCl的物质的量浓度为 ______ molL-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______ .
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次并在操作步骤空白处填上适当仪器名称) ______ .
A.用30mL水洗涤 ______ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 ______ 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括 号内填“偏大”,“偏小”,或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面 ______
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评 价 |
A | NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH- = BaSO4↓ + 2H2O | 正 确 |
B | 向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O = Fe(OH)3↓+3H+ | 正 确 |
D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
选项 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
弱电解质 | HF | CaCO3 | HClO | NH3 |
非电解质 | SO2 | 金属Al | H2O | C2H5OH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①Cl2②铝③醋酸(CH3COOH)④CO2⑤H2SO4⑥熔融Ba(OH)2 ⑦氨水⑧稀硝酸⑨Al2(SO4)3固体 ⑩NaHSO4
(1)按物质的分类方法填写表格的空白处:
属于非电解质的是__________;属于弱电解质的是________;属于强电解质的是__________;能导电的是____________。
(2)写出③溶于水时的电离方程式________________________________________。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量①。反应方程式为: KMnO4 + HCl(浓) —— KCl + MnCl2 + Cl2↑ + H2O(未配平)
配平上述反应并用双线桥法标出反应中电子转移的方向和数目:____________________
KMnO4 + HCl(浓) —— KCl + MnCl2 + Cl2↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
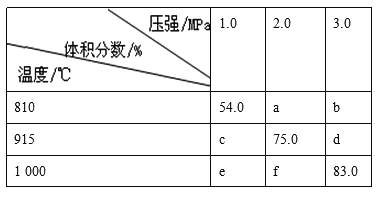
①b<f ②915℃、2.0 MPa时E的转化率为60% ③该反应是△S>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A. 4个 B. 3个 C. 2个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工厂的废水中含有较多的H+、Cu2+、Fe2+、SO42-、AsO43-、HAsO42-、 H2AsO4-等需要处理的杂质离子,其中一种处理流程如图所示

已知:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)2]=8.6×10-16;H3AsO4为弱酸。
(1)沉淀A的主要成分的化学式是__________________。
(2)常温下pH=7的溶液中Cu2+的物质的量浓度为_______,此时Fe2+是否沉淀完全_______(填“是”或“否”)。
(3)若氧化过程中生成了某种胶体,用离子方程式解释氧化过程中溶液pH降低的原因__________。
(4)最后一次调节pH时pH过低或过高砷的去除率都会明显降低,pH过低时可能的原因是________(从平衡角度解释);pH过高时可能的原因是_________________(从沉淀转化的角度解释)。
(5)硫化法是另一种处理含砷废水的方法,涉及的反应有
Na2S+H2SO4![]() Na2SO4+H2S ①
Na2SO4+H2S ①
2H3AsO3+3H2S![]() As2S3↓+6H2O ②
As2S3↓+6H2O ②
As2S3+H2SO4(浓) ![]() As2O3↓+4S↓+H2O ③
As2O3↓+4S↓+H2O ③
在反应①和③中,硫酸表现出的性质依次是_______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com