
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 ①由△H<0可知,该反应为放热反应,升高温度,平衡逆向移动,K减小;
②互为逆反应时,K互为倒数关系,以此来计算.
解答 解:①由△H<0可知,该反应为放热反应,升高温度,平衡逆向移动,K减小,则K1>K2,
故答案为:>;
②由表格数据可知,400℃时N2(g)+3H2(g)?2NH3(g)K=0.5,则400℃时,其逆反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为$\frac{1}{0.5}$=2,
故答案为:2.
点评 本题考查化学平衡的计算,为高频考点,把握温度与K的关系、正逆反应K的关系为解答的关键,侧重分析与计算能力的考查,注意表格数据的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
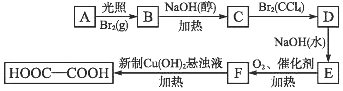
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
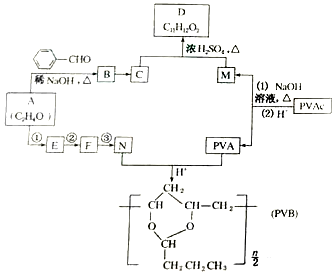
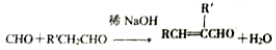 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)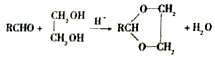
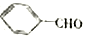 合成B的化学方程式是
合成B的化学方程式是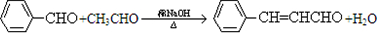 .
.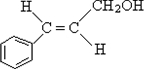 .
.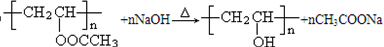 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 起始(mL) | 终点(mL) | |
| 1 | 5.00 | 20.02 |
| 2 | 3.00 | 18.00 |
| 3 | 4.00 | 18.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
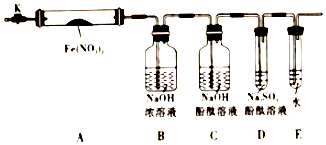 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com