
铁及其化合物与生产、生活关系密切。
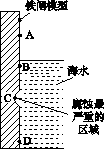
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
(1)①吸氧腐蚀 ②B
(2)①4HNO3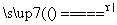 4NO2↑+O2↑+2H2O ②4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O ③氮氧化物排放少(或其他合理答案) (3)①4∶1 ②0.05
4NO2↑+O2↑+2H2O ②4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O ③氮氧化物排放少(或其他合理答案) (3)①4∶1 ②0.05
[解析] (1)①若为析氢腐蚀则B、C、D的腐蚀程度相同,则该电化学腐蚀为吸氧腐蚀。②氧气的浓度越大,吸氧腐蚀越严重,则B区域产生铁锈最多。(2)①硝酸的受热分解产生NO2、O2、H2O ,则根据氧化还原的化合价升降法配平其化学方程式为4HNO3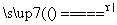 4NO2↑+O2↑+2H2O。②根据图示和信息可知:该生产流程中生成了 NH4NO3,则硝酸与废铁皮反应的化学方程式为 4Fe+10HNO3===4Fe(NO3)2+ NH4NO3+3H2O。
4NO2↑+O2↑+2H2O。②根据图示和信息可知:该生产流程中生成了 NH4NO3,则硝酸与废铁皮反应的化学方程式为 4Fe+10HNO3===4Fe(NO3)2+ NH4NO3+3H2O。
(3)①在t ℃时,K= =
= =0.25,则
=0.25,则 =4。
=4。
② FeO(s)+ CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)
n起始/mol 0.02 x 0 0
n转化/mol 0.01 0.01 0.01 0.01
n平衡/mol 0.01 x-0.01 0.01 0.01
根据t ℃时,K=  =
=  =
= =0.25 ,求得x=0.05。
=0.25 ,求得x=0.05。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝士矿中制备铝的工艺流程:
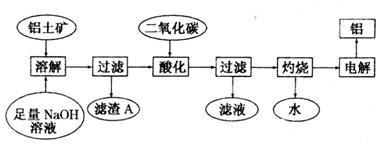
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的Na2SiO3与Na[A1(OH)4]反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[A1(OH)4]==Na2A12Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中主要发生反应的离子方程式:
___________________________________、__________________________________。
(2)滤渣A的主要成分为___________;滤渣A的用途是(只写一种)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中占分数(α)随pH变化的关系如图所示 。下列表述正确的是( )

A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。

(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_________________________。
(2)Ⅱ中,2NO(g)+O2(g)  2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

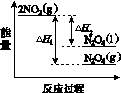

A B C
②N2O4与O2、H2O化合的化学方程式是________________________________________。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是________,说明理由:________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
 (3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
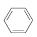 (g)
(g)  (g)+3H2(g)。
(g)+3H2(g)。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
① CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g)
CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)
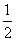 C(s)+
C(s)+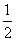 CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g) CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。

(2)反应①~③的平衡常数的对数lg K随反应温度T的变化曲线如图所示。结合各反应的ΔH,归纳lg K~T曲线变化规律:
a.________; b.________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________________________,在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+ PCl3(g)=4PCl5(g)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2  2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。

(4)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器 是 。
A.pH计 B.元素分析仪
C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
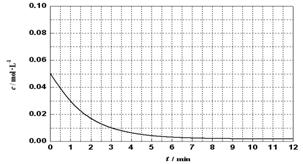
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com