
【题目】根据如图所示电化学实验装置图,回答有关问题。
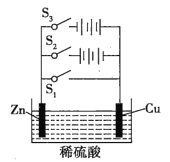
(1)若只闭合S1,该装置属于_______,能量转化形式为_______,锌极作_______极。
(2)若只闭合S2,该装置属于_______,能量转化形式为_______,锌极上的电极反应式为_______。
(3)若只闭合S3,该装置属于_______,铜极作_______极,锌极上的电极反应式为_______,总反应的化学方程式为_______。
【答案】原电池 化学能转化为电能 负 电解池 电能转化为化学能 ![]() 电解池 阳
电解池 阳 ![]()
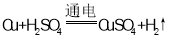
【解析】
原电池是将化学能转化为电能,较活泼金属作负极,发生氧化反应,正极发生还原反应;电解池是将电能转化为化学能,需要外接电源,与电源正极相连的为阳极,阳极发生氧化反应,阴极发生还原反应,据此解答。
(1)若只闭合S1,没有外接电源,则Zn、Cu、稀硫酸构成原电池,该装置将化学能转化为电能,较活泼的锌作负极。
答案为:原电池;化学能转化为电能;负。
(2)若只闭合S2,装置中有外接电源,该装置为电解池,将电能转为化学能,与电源正极相连的锌极作阳极,发生氧化反应,电极反应为Zn-2e-=Zn2+。
答案为:电解池;电能转化为化学能;Zn-2e-=Zn2+。
(3)若只闭合S3,该装置为电解池,与电源正极相连的铜极作阳极,电极反应式为:Cu-2e-=Cu2+;锌为阴极,电极反应式为:2H++2e-=H2↑,总反应式为:Cu+H2SO4 ![]() CuSO4+H2↑。
CuSO4+H2↑。
答案为:电解池;阳;2H++2e-=H2↑;Cu+H2SO4 ![]() CuSO4+H2↑。
CuSO4+H2↑。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】一定温度下进行反应:COCl2(g)![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A.0~4s容器内的压强逐渐增大
B.生成Cl2的平均反应速率,0~2s比2~4s快
C.8s时向容器中再充入一定量的氦气,反应速率又会加快
D.该条件下,COCl2的最大转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用热化学方程式表示:
①1mol N2(g)与适量O2(g)起反应,生成2 mol NO2(g),吸收68kJ热量。___________
②4g CO在氧气中燃烧生成CO2,放出9. 6kJ热量_____________________________________
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为_________________________________________________。
②又已知![]() ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是____________________kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两元素的最外层都只有一个电子,A的原子序数等于B的原子序数的11倍,A离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素C与B易形成化合物B2C,该化合物常温下呈液态,则:
(1)A的原子结构示意图为____,在固态时属于___晶体。
(2)C的单质属于___晶体。B与C形成化合物B2C的化学式为___,电子式为____;它是由___键形成的___分子,在固态时属于___晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
现象或事实 | 解释 | |
A | 用热的纯碱溶液去油污 | Na2CO3可直接与油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(主要成分K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl在潮湿的土壤中会反应生成氨气,降低肥效 |
D | FeCl3溶液可用于铜质印刷线路板制作 | Cu能从FeCl3溶液中把铁还原为游离态 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1×10-20,下列说法中正确的是( )
A.该溶液的溶质不可能是NaHCO3B.该溶液的pH一定是10
C.该溶液的溶质不可能是NaHSO4D.该溶液的溶质可能是正盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是( )
A.NH4Cl的水解常数表达式:![]()
B.NaHCO3水解的离子方程式:HCO3- + H2O ![]() H3O + + CO32-
H3O + + CO32-
C.结构示意图为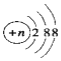 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.H2SO3的电离方程式:H2SO3![]() 2H+ + SO32-
2H+ + SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
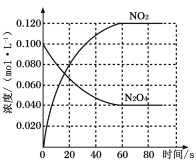
(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com