
| A. | 只有① | B. | ①或② | C. | 只有④ | D. | ③或④ |
分析 室温时,Kw=1×10-14,则pH=12的某溶液中c(H+)=1×10-12mol/L,c(OH-)=1×10-2mol/L,可为碱溶液,也可能为强碱弱酸盐溶液.
分类讨论.
解答 解:室温时,Kw=1×10-14,则pH=12的某溶液中c(H+)=1×10-12mol/L,c(OH-)=1×10-2mol/L,可为碱溶液,也可能为强碱弱酸盐溶液.
①若为碱溶液,则氢离子全部来自于水的电离,而水电离出的氢离子和氢氧根的浓度相等.故溶液中水电离出的c(OH-)=c(H+)=1×10-12mol/L,故④正确;
②若为强碱弱酸盐溶液,氢离子和氢氧根全部来自于水的电离,但由于氢离子被结合,故溶液中的氢氧根的浓度是水电离出的全部,故水电离出的c(OH-)=1×10-2mol/L,故③正确.
故选D.
点评 本题考查PH的简单计算和分类讨论的思想,题目难度不大,注意酸碱溶液和盐溶液中氢离子、氢氧根的来源.


科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol•L-1 CH3COONa溶液:Mg2+、H+、Cl-、SO42+ | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
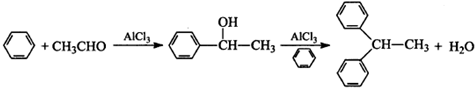
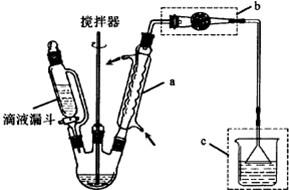
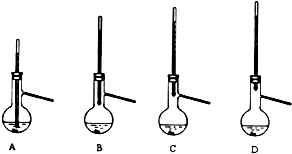
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
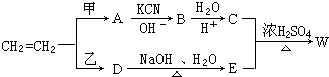
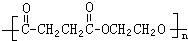 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
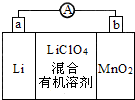
| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-=MnO2- | |
| C. | 用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度 | |
| D. | Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、I- | B. | H+、NH4+、HCO3-、NO3- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | Ag+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
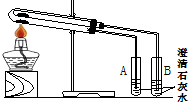 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com