
下列化学反应中,属于氧化还原反应的是
A.NaOH+HCl=NaCl+H2O B.NH3+HCl=NH4Cl
C.2FeC12+Cl2=2FeC13 D.H2CO3=H2O+CO2
科目:高中化学 来源: 题型:选择题
| A. | 大量使用化肥和农药,能不断提高农作物产量 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
下列情境中,对分离原理说法错误的是
A.沙里淘金,利用了沙子和金子的密度不同
B.海水晒盐,利用了水和NaCl的沸点不同
C.酒糟酿酒,利用了粮食和酒精分子的颗粒大小不同
D.植物油能萃取蔬菜汁中的植物精华——维生素,利用了维生素在水和油中溶解度不同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列有关气体体积的叙述中,正确的是
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
B.不同的气体,若体积不同,则它们所含的分子数也不同
C.一定温度和压强下,各种气体体积大小,由构成气体分子的大小决定
D.气体摩尔体积就是1mol任何气体所占体积都约为22.4L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
mgO2中含n个氧原子,则阿伏加德罗常数的值可表示为
A.2n B.16n/m C.32n/m D.n
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定完成时,消耗盐酸的体积/mL |
| 1 | 20.00 | 22.40 |
| 2 | 20.00 | 22.42 |
| 3 | 20.00 | 22.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
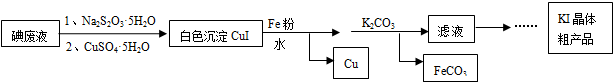
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
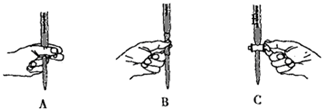
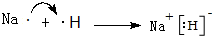 .
.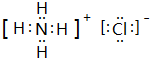 ,A2C2的电子式为
,A2C2的电子式为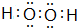 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com