
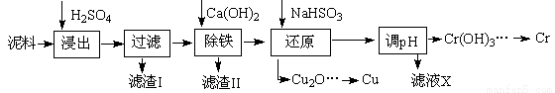
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
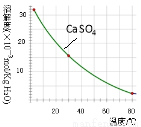
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ | Cu2+ | Cr3+ |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到 ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度≤1×10—5 mol?L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥ 。已知:Ksp[Cr(OH)3]=6.3×10-31,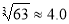 )
)
(1)CuSO4 (3分)
(2)①3.2 (2分) ②趁热过滤 (2分)
(3)2H2O + HSO3— +2Cu2+=Cu2O↓+SO42— +5H+(3分); 产生SO2污染环境(3分)
(4)4.0×10-9mol/L (3分)
【解析】
试题分析:(1)Fe2O3、CuO、Cr2O3与硫酸反应生成Fe2(SO4)3、CuSO4、Cr2(SO4)3,所以在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4;
(2)①除铁操作中铁离子沉淀完全,而铜离子与铬离子不能沉淀,铁离子沉淀完全的pH是3.2所以调节溶液pH到3.2;80℃时CaSO4的溶解度已经很小,此时以固体形式存在,若不趁热过滤,温度下降后,CaSO4的溶解度又增大,重新回到溶液中,达不到除杂目的,所以将浊液加热到80℃,要趁热过滤,以除去CaSO4
(3)Cu元素以Cu2+形式存在于溶液中,加入NaHSO3二者发生氧化还原反应,生成Cu2O固体,HSO3—被氧化成SO42—,所以离子方程式为2H2O+HSO3— +2Cu2+=Cu2O↓+SO42—+5H+;若NaHSO3过量,则该步骤中Cu2+被还原后的溶液酸性增强,则H+会与过量的NaHSO3反应产生SO2,污染环境;
(4)Cr3+完全沉淀时C(Cr3+)≤1×10—5 mol?L-1,而Ksp[Cr(OH)3]= C(Cr3+)·C(OH—)3=6.3×10-31,C(OH—)3= 6.3×10-31/ C(Cr3+)≥6.3×10-26,所以C(OH—) ≥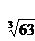 ×10-9=4.0×10-9。
×10-9=4.0×10-9。
考点:考查对工业流程的分析,反应产物、pH的判断,Ksp的有关计算,离子方程式的书写


科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如图:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如图:
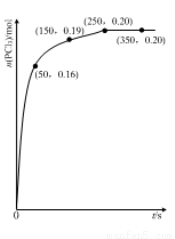
下列说法正确的是
A.反应在前50 s 的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80%
D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
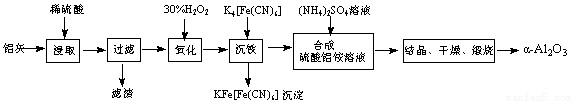
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 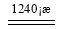 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
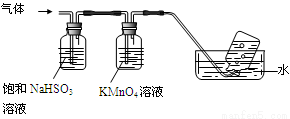
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
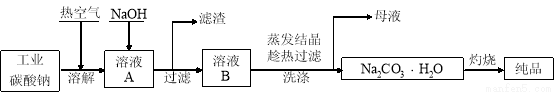
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
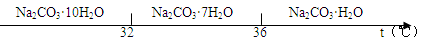
回答下列问题:
(1)溶解时通入热空气的作用有 (写出两条即可);生成氢氧化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 ;简述过滤后洗涤固体的操作 。
(3)为检验母液中是否含有Cl-,必须加入的试剂为 。
(4)实验室进行“灼烧”的陶瓷仪器有 。
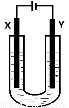
(5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极反应式: ;一段时间后X电极可收集到的气体一定有 ,可能有 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是(相对原子质量:D-2 O-16 Cu-64)
A.18 g的D216O中含有的中子数为9 NA
B.物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.33.6 L NO2溶于足量的水得到的溶液中含有的NO3-数为NA
D.32 g铜发生氧化还原反应,一定失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体
B.将混有少量HCl的CO2通入饱和NaHCO3溶液中除去HCl
C.测定等浓度的Na2CO3和Na2SO3 溶液的pH大小,可比较非金属性: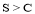
D.用AgNO3溶液鉴别Na2SO4溶液与NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:填空题
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
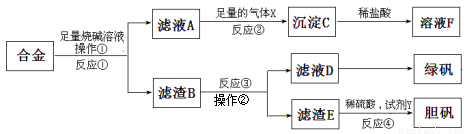
请回答:
(1)绿矾的化学式为 。
(2)写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
高炉炼铁过程中发生的反应: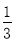 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
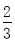 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.△H<0
B.该反应的平衡常数表达式是K=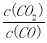
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以降低CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com