

| ||
| ||


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)c(CO) |
| c(H2O) |
| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Nutrition Facts 营养成分 500mL含量 | |
| 热量 710kJ | 碳水化合物 42g |
| 蛋白质 0g | 脂肪酸 0g |
| 维生素C 100mg | |
| 中国居民膳食营养素日推荐摄入量(RNI): 维生素C 100mg | |
查看答案和解析>>
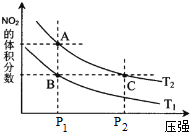
科目:高中化学 来源: 题型:
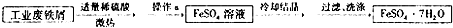
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
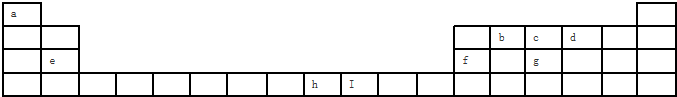
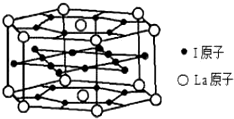
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
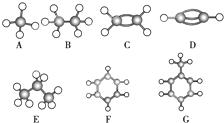 A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
A~G是几种烃的分子球棍模型(如图),据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com