
分析 先判断强弱电解质,强电解质完全电离,电离方程式用等号,弱电解质部分电离,电离方程式用可逆号,据此进行解答.
解答 解:(1)硫酸为强电解质,在溶液中完全电离,其电离方程式为:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为:CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
(3)NH3•H2O为弱电解质,在溶液中部分电离,其电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(4)Fe(OH)3为三元弱碱,部分电离,用可逆符号,多元弱碱,只需一步书写,电离出Fe3+、OH-,其电离方程式为:Fe(OH)3?Fe3++3OH-;
故答案为:Fe(OH)3?Fe3++3OH-;
(5)NaHCO3是H2CO3的酸式盐,属强电解质,完全电离用“═”,HCO3-不能拆,其电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(6)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离用“═”,电离出Na+、H+、SO42-离子,其电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查了电离方程式的书写方法,题目难度不大,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的概念及判断方法,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
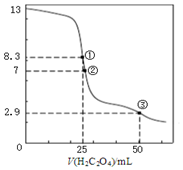 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 | |
| C. | 醋酸钠溶液呈一定的碱性 | |
| D. | 0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com