
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 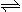 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
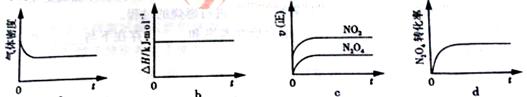
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
【知识点】原电池原理、化学平衡的移动 F3 G2 H1
【答案解析】(1)N2O4+8e-+8H+=N2+4H2O ; (2)吸热 (3)a,d;不变;0.1 (4)NH4++H2O NH3.H2O+H+
NH3.H2O+H+
逆向;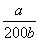
解析:(1)根据原电池得正极发生还原反应,结合酸性电解质,得到正极的电极反应式为: N2O4+8e-+8H+=N2+4H2O ;
(2)温度升高时,气体颜色变深,说明升高温度平衡向正反应方向移动,则反应(Ⅱ)为吸热反应。
(3)恒压密闭容器中,随着反应的进行气体的物质的量增大,容器体积增大,密度减小,当气体密度不变时意味着平衡不再移动,a 图正确,;b.ΔH不变不能作为平衡状态的标志;c.速率减小,c图错误;d.的转化率先增大,不变时说明反应达最大限度说明反应达到平衡状态,d正确;化学平衡常数只与温度有关,所以不变;3s后NO2的物质的量为0.6mol,则0~3s 内的平均反应速率vNO2=0.6mol/(1L·3s)=0.2mol·L-1·s-1 则0~3s内的平均反应速率v(N2O4)=0.1mol·L-1·s-1。
(4)将amol NH4NO3溶于水,溶液显酸性,原因是铵根离子水解:NH4++H2O NH3.H2O+H+
NH3.H2O+H+
原溶液是盐溶液,盐水解促进水的电离,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向移动,
根据电荷守恒式:C(NH4+)+C(H+)=C(OH-)+C(NO3-),溶液呈中性C(NH4+)=C(NO3-),结合电离平衡常数表达式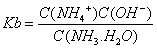 得到所滴加氨水的浓度。
得到所滴加氨水的浓度。
【思路点拨】本题考查了原电池原理、化学平衡的移动等知识,理解化学平衡状态是关键。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B两种有机物的有关信息:
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为 ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为: |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做
________________________________________________________________________;
写出在一定条件下,A生成高分子化合物的化学反应方程式:
________________________________________________________________________。
(2)A与氢气发生加成反应后生成C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=________时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤能使酸性KMnO4溶液和溴水褪色、⑥任何条件下不与氢气反应。
写出在浓硫酸作用下,B与浓硝酸在60℃反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向1.0 L 0.30 mol·L-1的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.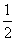 c(Na+)=c(HCO
c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
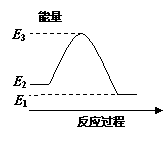
.反应X(g)+Y(g)  2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
查看答案和解析>>
科目:高中化学 来源: 题型:
核黄素又称维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:
已知: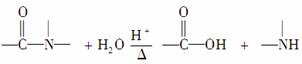 有关核黄素的下列说法中,不正确的是( )
有关核黄素的下列说法中,不正确的是( )
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com