
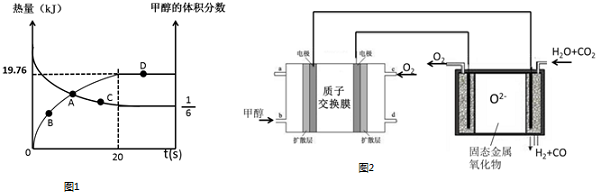
分析 (1)反应前c(CH3OH)=$\frac{1.2mol}{2L}$=0.6mol/L、c(H2O)=$\frac{2.8mol}{2L}$=1.4mol/L,
设参加反应的c(CH3OH)为xmol/L,
CH3OH(g)+H2O(g)?CO2(g)+3H2(g)
反应前(mol/L)0.6 1.4 0 0
反应(mol/L) x x x 3x
平衡(mol/L)0.6-x 1.4-x x 3x
根据图知,反应后甲醇的体积分数占$\frac{1}{6}$,相同条件下体积之比等于其物质的量之比,所以甲醇的物质的量分数=$\frac{0.6-x}{(0.6-x)+(1.4-x)+x+3x}$=$\frac{1}{6}$,x=0.2
则生成c(H2)=3x=3×0.2mol/L=0.6mol/L,
v(H2)=$\frac{△c}{△t}$;
(2)参加反应的n(CH3OH)=0.2mol/L×2L=0.4mol,有0.4mol甲醇反应吸收19.76kJ热量,据此计算1mol甲醇反应吸收的热量;
化学平衡常数K=$\frac{c(C{O}_{2}).{c}^{2}({H}_{2})}{c(C{H}_{3}OH).c({H}_{2}O)}$;
(3)根据图知,从B点到C点,甲醇的体积分数在减小,说明平衡正向移动,水的物质的量减小;
(4)根据浓度商与化学平衡常数相对大小确定反应方向,如果浓度商等于平衡常数,则平衡不移动;
(5)甲醇燃料酸性电池中,负极上甲醇失电子发生氧化反应;
(6)电解池中,反应物是水和二氧化碳,生成物是氢气、CO和氧气;
(7)串联电路中转移电子相等,根据转移电子相等计算生成氢气体积.
解答 解:(1)反应前c(CH3OH)=$\frac{1.2mol}{2L}$=0.6mol/L、c(H2O)=$\frac{2.8mol}{2L}$=1.4mol/L,
设参加反应的c(CH3OH)为xmol/L,
CH3OH(g)+H2O(g)?CO2(g)+3H2(g)
反应前(mol/L)0.6 1.4 0 0
反应(mol/L) x x x 3x
平衡(mol/L)0.6-x 1.4-x x 3x
根据图知,反应后甲醇的体积分数占$\frac{1}{6}$,相同条件下体积之比等于其物质的量之比,所以甲醇的物质的量分数=$\frac{0.6-x}{(0.6-x)+(1.4-x)+x+3x}$=$\frac{1}{6}$,x=0.2
则生成c(H2)=3x=3×0.2mol/L=0.6mol/L,
v(H2)=$\frac{△c}{△t}$=$\frac{0.6mol/L}{20s}$=0.03mol/(L•s),
故答案为:0.03mol/(L•s);
(2)参加反应的n(CH3OH)=0.2mol/L×2L=0.4mol,有0.4mol甲醇反应吸收19.76kJ热量,据此计算1mol甲醇反应吸收的热量=$\frac{19.76kJ}{0.4mol}$=+49.4kJ/mol;
化学平衡常数K=$\frac{c(C{O}_{2}).{c}^{2}({H}_{2})}{c(C{H}_{3}OH).c({H}_{2}O)}$=$\frac{0.2×0.{6}^{3}}{0.4×1.2}$=0.09(mol/L)2,
故答案为:+49.4kJ/mol;0.09(mol/L)2;
(3)根据图知,从B点到C点,甲醇的体积分数在减小,说明平衡正向移动,水的物质的量减小,B点时水的体积分数大于C点,故答案为:>;
(4)再充入7.2mol水蒸气,c(H2O)=$\frac{7.2mol}{1L}$=7.2mol/L,缩小容器体积时,c(CH3OH)=0.8mol/L、c(H2O)
=9.6mol/L、c(CO2)=0.4mol/L、c(H2)=1.2mol/L,
浓度商=$\frac{0.4×1.{2}^{3}}{0.8×9.6}$=0.09,其浓度商等于化学平衡常数,所以平衡不移动,
故答案为:不;
(5)甲醇燃料酸性电池中,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+;
(6)电解池中,反应物是水和二氧化碳,生成物是氢气、CO和氧气,则电池反应式为H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,
故答案为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2;
(7)串联电路中转移电子相等,正极反应式为O2+4e-+4H+=2H2O,通过离子交换膜的氢离子是4,当质子交换膜中通过的H+数目为4.816×1023时,通过的氢离子物质的量=$\frac{4.816×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.8mol,转移0.8mol电子得到0.8mol电子,
根据转移电子相等得生成氢气体积=$\frac{0.8mol}{4}×1×22.4L/mol$=4.48L,
故答案为:4.48.
点评 本题考查化学平衡有关计算、原电池原理等知识点,为高频考点,侧重考查学生分析计算及知识综合运用能力,根据平衡常数与浓度商相对大小确定反应方向为该题难点,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
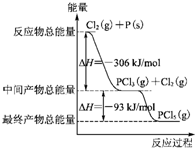 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:
某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
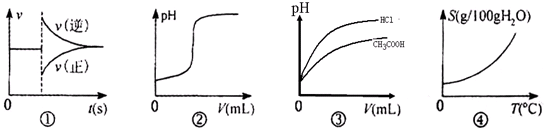
| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH的变化 | |
| C. | 图③可以表示相同pH的醋酸和盐酸溶液分别加水稀释时溶液的pH随体积的变化 | |
| D. | 图④可以表示所有的固体物质溶解度随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
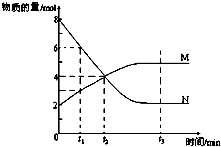 一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→Na++CO32- | B. | H2S→2H++S2- | ||
| C. | H2CO3→H++HCO3- | D. | NaHSO4→Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精和水:分液 | |
| B. | 淀粉溶液(胶体)中混有氯化钠:用半透膜进行渗析 | |
| C. | 汽油和柴油:分馏 | |
| D. | 三氯甲烷和水:分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com