
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
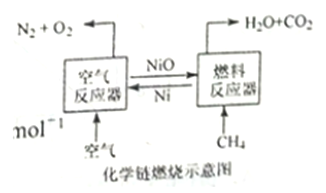
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
【答案】C
【解析】已知:①2Ni(s)+O2(g)=2NiO(s)△H1=-479.8 kJ·mol-1
②CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H2=akJ·mol-1
③CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H3=b kJ·mol-1
④CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H4=+156.9 kJ·mol-1
A. 根据盖斯定律,由②![]() ③得反应CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1,选项A正确;B. 根据盖斯定律,由①
③得反应CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1,选项A正确;B. 根据盖斯定律,由①![]() ④得反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1,选项B正确;C. 甲烷在“燃料反应器”中反应时不是甲烷的燃烧反应,不产生淡蓝色火焰,选项C错误;D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收,选项D正确。答案选C。
④得反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1,选项B正确;C. 甲烷在“燃料反应器”中反应时不是甲烷的燃烧反应,不产生淡蓝色火焰,选项C错误;D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收,选项D正确。答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
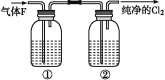
【题目】为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用双线桥法对该反应进行标注_________________________________。
(2)写出该反应的离子方程式________________。
(3)该同学用43.5g MnO2与足量的 HCl(浓)反应,可制备标况下的氯气的体积为_______ L,反应中转移的电子的物质的量为_______mol,反应中被氧化的HCl物质的量为_______mol。
(4)在实验室中,欲用如图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①____,②_____(填试剂名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO、Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
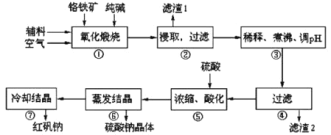
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________。
(2)“③”中调节pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式:________。
,请写出该平衡转化的离子方程式:________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶(锥形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)该反应的化学方程式为_____。
(2)从反应开始到10s时,用Y表示的反应速率为________,X的转化率为_____ 。
(3)10s时,该反应 ___ 达到了化学平衡状态。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li/Li2O体系的能量循环图如图所示。已知,△H4>0。下列说法正确的是

A. △H3<0
B. △H3+△H4+△H5=△H6
C. △H6>△H5
D. △H1+△H2+△H3+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用反应2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH检测乙醇。下列说法错误的是( )
A.基态Cr3+的核外电子排布式为3d3
B.[Cr(H2O)6]3+中与Cr3+形成配位键的原子是氧原子
C.CH3COOH分子中含有7个![]() 键
键
D.已知CrO42-是以Cr为中心的四面体结构,则Cr2O72-结构中含有两个四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO![]() 和NH
和NH![]() B.H3O+和ClO
B.H3O+和ClO![]()
C.NO![]() 和CO
和CO![]() D.PO
D.PO![]() 和SO
和SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO![]() +5HSO
+5HSO![]() +H+=2Mn2++5SO42-+3H2O
+H+=2Mn2++5SO42-+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A酸式滴定管(50 mL) B碱式滴定管(50 mL) C量筒(10 mL) D锥形瓶 E铁架台
F滴定管夹 G烧杯 H白纸 I胶头滴管 J漏斗
(2)不能用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________。
(3)选何种指示剂,说明理由____________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com