
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |
分析 A.醋酸纤维属于纤维素醋酸酯;
B.顺-2-丁烯和反-2-丁烯互为同分异构体,二者结构不同,性质不同;
C.脱氧核糖核酸属于高分子化合物;
D.羟基活化了苯环.
解答 解:A.醋酸纤维属于纤维素醋酸酯,属于酯类化合物,故A正确;
B.顺-2-丁烯和反-2-丁烯互为同分异构体,二者结构不同,性质不同,二者的沸点不同,故B正确;
C.脱氧核糖核酸是含磷的高分子有机化合物,故C正确;
D.苯酚中羟基苯环越羟基向连接,导致这种现象的原因是羟基影响了苯环的活性,故D错误.
故选D.
点评 本题考查了有机物结构与性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的组成、结构和性质,题目难度中等,有利于培养学生良好的科学素养.


科目:高中化学 来源: 题型:解答题
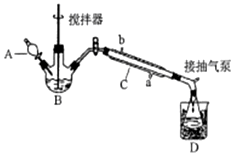 过氧乙酸(
过氧乙酸( 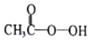 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个-CH3,能生成3种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成2种一氯代物 | D. | 4个-CH3,能生成2种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,由H2O2制得2.24L O2转移的电子数为0.4NA | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64g | |
| C. | NO2和H2O反应生成2mol HNO3时转移的电子数为4NA | |
| D. | 常温常压下,11.2L NH3中所含氮原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 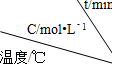 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
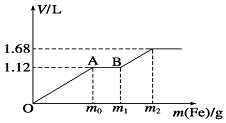 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com