
分析 (1)平衡常数数值比较可知溶液酸性,得到溶液PH大小;
(2)依据电离平衡常数计算溶液中氢离子浓度得到溶液PH;醋酸电离平衡状态下溶液中已经电离的电解质分子数占原来电解质总分子数的百分数叫电离度,温度不变电离平衡常数不变,据此列式计算;
(3)Na2C2O4第一步水解反应,C2O42-+H2O?HC2O4-+OH-,水解平衡常数Kh=$\frac{c(H{C}_{2}{{O}_{4}}^{-})c(O{H}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$,室温下,向0.01 mol/LNa2C2O4溶液中滴加盐酸至pH=1时,溶液中HC2O4-与H2C2O4物质的量浓度之比=$\frac{c(H{C}_{2}{{O}_{4}}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$;
解答 解\;(1)平衡常数数值比较可知溶液酸性,得到溶液PH大小:②草酸>④邻-苯二甲酸>①醋酸>HC2O4->邻苯二甲酸氢根>③硼酸,25℃时,0.1 mol/L的上述四种酸溶液,pH由小到大的顺序是②④①③,
故答案为:②④①③;
(2)25℃时,0.1 mol/L醋酸溶液中电离出的氢离子浓度为x,
CH3COOH?CH3COO-+H+,
0.1mol/L 0 0
0.1-x x x
结合平衡常数计算得到,Ka=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{x}^{2}}{0.1-x}$=1.8×10-5,x=$\sqrt{1.8×1{0}^{-6}}$,溶液PH=-lg$\sqrt{1.8×1{0}^{-6}}$≈2.9,
将0.1 mol/L醋酸溶液稀释10倍,电离度之比=$\frac{\frac{{c}_{1}({H}^{+})}{0.01}}{\frac{c({H}^{+})}{0.1}}$=$\frac{10{c}_{1}({H}^{+})}{c({H}^{+})}$=10×$\frac{\sqrt{Ka×0.01}}{\sqrt{Ka×0.1}}$=$\sqrt{10}$,
故答案为:2.9; $\sqrt{10}$;
(3)(3)Na2C2O4第一步水解反应,C2O42-+H2O?HC2O4-+OH-,水解平衡常数Kh=$\frac{c(H{C}_{2}{{O}_{4}}^{-})c(O{H}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$,室温下,向0.01 mol/LNa2C2O4溶液中滴加盐酸至pH=1时,溶液中HC2O4-与H2C2O4物质的量浓度之比=$\frac{c(H{C}_{2}{{O}_{4}}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$=$\frac{5.9×1{0}^{-2}}{0.1}$=0.59,
故答案为:$\frac{c(H{C}_{2}{{O}_{4}}^{-})c(O{H}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$;0.59.
点评 本题考查了弱电解质电离平衡、电离度计算、盐类水解平衡常数计算等掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯、油脂、糖类、蛋白质都可以发生水解反应 | |
| B. | 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 | |
| C. | 油脂在碱性条件下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
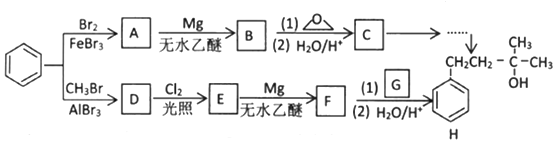
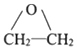 →R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH
→R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH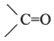 →
→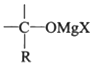 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$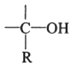
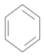 +CH3Br$→_{.}^{AlBr_{3}}$
+CH3Br$→_{.}^{AlBr_{3}}$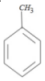 +HBr
+HBr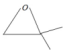
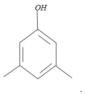
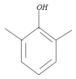 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 电极材料. | 电解质溶液 | 电流计指针 |
| 1 | Mg、Al | 稀盐酸 | 偏转 |
| 2 | Al、Cu | 稀盐酸 | 偏转 |
| 3 | A1、C(石墨) | 稀盐酸 | 偏转 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
| 5 | Al、Zn | 浓硝酸 | 偏转 |
| A. | 实验1、2中铝所作的电极(正极或负极)不相同 | |
| B. | 实验2、3中,铝电极的电极反应式均为Al-3e-═Al3+ | |
| C. | 实验4中铝电极的电极反应式为:Al-3e-+40H-═A102-+2H2O | |
| D. | 实验5中铝作原电池的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 药物是一种传统的治疗感冒发烧的“老药”,其结构如图,但大剂量空腹服用,它容易对胃肠道产生刺激,为了减少这种副作用,一般宜饭后服药,用时服用少量辅助药物,以下可以用作辅助药物的是( )
药物是一种传统的治疗感冒发烧的“老药”,其结构如图,但大剂量空腹服用,它容易对胃肠道产生刺激,为了减少这种副作用,一般宜饭后服药,用时服用少量辅助药物,以下可以用作辅助药物的是( )| A. | BaCO3 | B. | MgSO4 | C. | Ba(OH)2 | D. | CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅有② | B. | 仅有②④ | C. | 仅有③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | A电极是负极,电极上发生氧化反应 | |
| B. | 该电池总反应:2H2+O2═2H2O | |
| C. | 由于A、B两电极没有活动性差别,不能构成原电池 | |
| D. | 外电路中电流由B电极通过导线流向A电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同的条件下,白磷比红磷稳定 | |
| B. | 在相同的条件下,红磷比白磷稳定 | |
| C. | 在相同的条件下,红磷所具有的总能量比白磷高 | |
| D. | 在相同的条件下,相同质量的红磷和白磷完全燃烧放出的热量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com