
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少 8%,氮氧化物(NOx)排放量减少 10%。目前,消除大气污染有多种方法。
(1)用 CH4 催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g)△H =-574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g)△H =-1160 kJ/mol
③H2O(g) = H2O(l) △H =-44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:__________。
(2)利用 Fe2+、Fe3+的催化作用,常温下可将 SO2 转化为 SO42-,从而实现对 SO2 的治理。已知含 SO2 的废气通入含 Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O,则另一反应的 离子方程式为__________。
(3)用活性炭还原法处理氮氧化物。有关反应为 C(s) + 2NO(g)  N2(g) + CO2(g)。某研究小组向密闭的真空 容器中(假设容器体积不变,固体试样体积忽略不计)加入 NO 和足量的活性炭,在恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g) + CO2(g)。某研究小组向密闭的真空 容器中(假设容器体积不变,固体试样体积忽略不计)加入 NO 和足量的活性炭,在恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
①10~20 min 以υ(N2)表示的反应速率为__________。
②该反应的平衡常数表达式 K=________。根据表中数据,计算 T1 ℃时该反应的平衡常数为__________(保留两位小数)。
③一定温度下,随着 NO 的起始浓度增大,则 NO 的平衡转化率__________ (填“增大”、“不变”或“减小”)。
④下列各项能作为判断该反应达到平衡的是__________ (填序号)。
A.混合气体的密度保持不变
B.υ正(NO) = 2υ逆(CO2)
C.容器内压强保持不变
D.容器内 N2 的体积分数保持不变
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和② B.②和④ C.③和④ D.①和③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.油脂水解可得到氨基酸
B.蛋白质水解可以得到高级脂肪酸
C.维生素是一类高分子化合物
D.淀粉和纤维素的组成的化学式可表示为(C6H10O5)n,水解最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:实验题
以下是有关SO2、Cl2的性质实验。
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
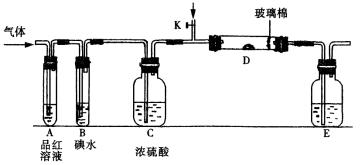
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.硝酸钠溶液 C.氯化钙溶液
若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
化学在生产、生活中应用广泛,下列说法正确的是
A.晶体硅是良好的半导体材料
B.铁、铝合金的熔点高于铁的熔点,硬度小
C.氨常用作制冷剂利用了氨的化学性质
D.漂白粉、明矾都可用于污水的净化,其原理是相同的
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:选择题
下列离子方程式,书写正确的是
A.用惰性电极电解熔融氯化钠:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH-
Cl2↑+ H2↑+ 2OH-
B.铁粉溶于稀硫酸:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.用 CuSO4 溶液吸收 H2S:Cu2+ + H2S = CuS↓+ 2H+
D.向 NH4HSO4 溶液中滴加少量的 Ba(OH)2 溶液:NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3•H2O+H2O
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:推断题
欲确定某无色透明溶液中是否含有下列离子: Cl-、I-、SO42-、HCO3-、NO3-、Na+、Mg2+、Al3+、Fe2+、Ba2+,取适量溶液分别装进①②③④号试管,进行如下实验,请依实验现象回答问题:
①加几滴石蕊试液, 溶液变红色
②浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③加BaCl2溶液, 立即白色沉淀生成。取上层清液,加AgNO3溶液, 出现白色沉淀,且不溶于HNO3
④加NaOH溶液, 有白色沉淀生成,当NaOH过量时沉淀部分溶解
(1)溶液中肯定存在的离子是 。
(2)溶液中肯定不存在的离子是 。
(3)为进一步确定其他离子,应该补充的实验是 。
(4)写出实验④中所有反应的离子方程式__________________
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列表述正确的是
A.1mol H2燃烧放出的热量为H2的燃烧热
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.NH4Br的电子式:
D.丙烯的结构简式:CH3CH=CH2
查看答案和解析>>
科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列关于化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.已知:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量
C.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H=akJ/mol,2C(s)+O2(g)=2CO(g) △H=bkJ/mol,则b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com