
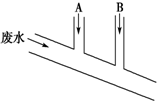
 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
分析 该废水处理需满足两个要求:一是除去Cl2;二是调为中性,因为Cl2跟SO32-与水反应时能生成H+,所以除去H+应在该反应之后进行,由此分析解答.
解答 解:A、排出管A处,废水中含有Cl2,可与SO32-发生氧化还原反应,发生反应的离子方程式为Cl2+SO32-+H2O═SO42-+2H++2Cl-,故A正确;
B、A反应后溶液呈酸性,则应先与亚硫酸钠发生氧化还原反应,然后再发生加入烧碱发生中和反应,废水排出管B处反应的离子方程式为H++OH-═H2O,故B正确;
C、由反应Cl2+SO32-+H2O═SO42-+2H++2Cl-,得到n(Cl2)=n(Na2SO3),所以0.014mol•L-1×10.0mL•s-1=0.10mol•L-1×v(A),所以v(A)=1.4 mL•s-1,故C正确;
D、B处溶氢离子的浓度为:0.001mol•L-1+0.028mol•L-1=0.029mol•L-1,所以B处溶液的流量为2.9 mL•s-1,故D错误;
故选D.
点评 本题考查氯气的性质,侧重于化学与环境污染的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大,注意相关基础知识的积累.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
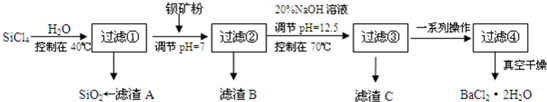
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
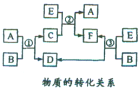 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.| E的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(F的阴离子)/mol | 1.25 | 1.5 | 2 |
| n(C中的阴离子)/mol | 1.5 | 1.4 | y |
| n(B中的阴离子)/mol | x | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛肉 | B. | 辣椒 | C. | 鸡蛋. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤加强热而分解的过程叫做煤的干馏 | |
| B. | 煤干馏的目的是得到冶金用的优质焦炭 | |
| C. | 煤的干馏和石油的分馏的本质差别是:干馏是化学变化,而分馏是物理变化 | |
| D. | 工业上芳香烃原料可由煤干馏得到,其存在于干馏所得的焦炉气中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com