
分析 1.00g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则1molN2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出的热量为19.14kJ×32=612.48kJ,结合物质的量与反应放出的热量成正比计算.
解答 解:1.00g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则1molN2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出的热量为19.14kJ×32=612.48kJ,可知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)的△H=-1224.96kJ•mol-1,
故答案为:-1224.96.
点评 本题考查反应热与焓变,为高频考点,把握物质的量与反应中热量变化成正比为解答的关键,侧重分析与计算能力的考查,注意放热时焓变为负,题目难度不大.


科目:高中化学 来源: 题型:实验题
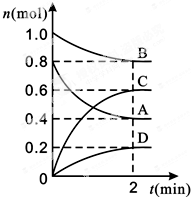 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
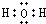 和
和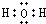 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 还原性:Na<Mg<Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com