
分析 (1)已知:①CH4(g)+4NO(g)=CO2(g)+2N2+2H2O(l)△H=-1250kJ•mol-1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ•mol-1
根据盖斯定律:$\frac{②-①}{2}$得N2(g)+O2(g)=2NO(g),据此计算;
(2)O3氧化NO结合水洗可产生HNO3和O2,结合原子守恒和得失电子守恒写出反应方程式;
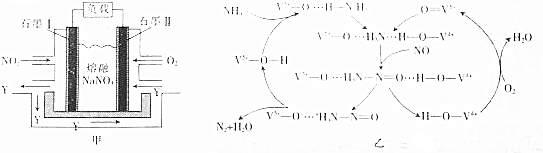
(3)该燃料电池中,负极上通入NO2,正极上通入O2,根据电解质知,负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-,据此分析解答.
解答 解:(1)已知:①CH4(g)+4NO(g)=CO2(g)+2N2+2H2O(l)△H=-1250kJ•mol-1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ•mol-1
根据盖斯定律:△H=$\frac{②-①}{2}$=$\frac{-890-(-1250)}{2}$=+180kJ•mol-1,故答案为:+180kJ•mol-1;
(2)O3氧化NO结合水洗可产生HNO3和O2,其反应方程式为:3O3+2NO+H2O═2HNO3+3O2;故答案为:3O3+2NO+H2O═2HNO3+3O2;
(3)石墨Ⅱ为正极,电极反应式为O2+2N2O5+4e-═4NO3-,所以NO3-向负极移动,即NO3-向石墨Ⅰ,故答案为:O2+2N2O5+4e-═4NO3-;Ⅰ.
点评 本题考查了化学方程式的书写、原电池的应用、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的物质的量之比为3:2 | B. | 两种容器的体积之比为2:3 | ||
| C. | 两种气体的分子数相等 | D. | 两种气体的密度之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
| B | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com