
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
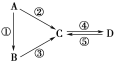
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:______________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。单质A能在空气中稳定存在的原因是_______________________________________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,C是一种矿物胶,可作防火剂,D溶液显碱性,常用于工业生产玻璃。写出②反应的化学方程式:_______________________________________________。D的化学式是________。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:____________________________________________________________。
(6)若B为淡黄色固体化合物;D属于盐类,其水溶液显碱性,②、③反应均要用到一种无色液体,写出反应⑤的化学方程式:_______________________________________________。
【答案】漂白、杀菌、消毒、作为生产硫酸的原料等(任写2个即可)4NH3+6NO![]() 5N2+6H2OAl在空气中发生缓慢氧化,在Al表面生成了致密的氧化物保护膜Si+2NaOH+H2O===Na2SiO3+2H2↑Na2CO3Cu+2Fe3+===Cu2++2Fe2+Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(合理即可)
5N2+6H2OAl在空气中发生缓慢氧化,在Al表面生成了致密的氧化物保护膜Si+2NaOH+H2O===Na2SiO3+2H2↑Na2CO3Cu+2Fe3+===Cu2++2Fe2+Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(合理即可)
【解析】
(1)若单质A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,则A为S、B为H2S、C为SO2,D为SO3;(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,则A为N2,B为NH3,C为NO,D为NO2;(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,则A为Al,B为Al2O3,C为NaAlO2,D为Al(OH)3;(4)若A是太阳能电池用的光伏材料,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,则A为Si,B为SiO2,C为Na2SiO3,D为Na2CO3;(5)若A是应用最广泛的金属,则A为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,则B为Fe2O3,C为FeCl3,D为FeCl2.(6)若B为淡黄色固体化合物;D属于盐类,其水溶液显碱性,②、③反应均要用到一种无色液体,则A为Na,B为Na2O2,C为NaOH,D为Na2CO3;
(1)若单质A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,则A为S、B为H2S、C为SO2,D为SO3,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途: 漂白、杀菌、消毒、作为生产硫酸的原料等(任写2个即可) ;(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,则A为N2,B为NH3,C为NO,D为NO2,反应③的化学方程式为:4NH3+6NO![]() 5N2+6H2O ;(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,则A为Al,B为Al2O3,C为NaAlO2,D为Al(OH)3,单质A能在空气中稳定存在的原因是:Al在空气中发生缓慢氧化,在Al表面生成了致密的氧化物保护膜;(4)若A是太阳能电池用的光伏材料,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,则A为Si,B为SiO2,C为Na2SiO3,D为Na2CO3,反应②的化学方程式为:Si+2NaOH+2H2O=Na2SiO3+2H2↑;D的化学式是Na2CO3;(5)若A是应用最广泛的金属,则A为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,则B为Fe2O3,C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:Cu+2Fe3+===Cu2++2Fe2+ .(6)若B为淡黄色固体化合物;D属于盐类,其水溶液显碱性,②、③反应均要用到一种无色液体,则A为Na,B为Na2O2,C为NaOH,D为Na2CO3;写出反应⑤的化学方程式:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(合理即可)。
5N2+6H2O ;(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,则A为Al,B为Al2O3,C为NaAlO2,D为Al(OH)3,单质A能在空气中稳定存在的原因是:Al在空气中发生缓慢氧化,在Al表面生成了致密的氧化物保护膜;(4)若A是太阳能电池用的光伏材料,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,则A为Si,B为SiO2,C为Na2SiO3,D为Na2CO3,反应②的化学方程式为:Si+2NaOH+2H2O=Na2SiO3+2H2↑;D的化学式是Na2CO3;(5)若A是应用最广泛的金属,则A为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,则B为Fe2O3,C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:Cu+2Fe3+===Cu2++2Fe2+ .(6)若B为淡黄色固体化合物;D属于盐类,其水溶液显碱性,②、③反应均要用到一种无色液体,则A为Na,B为Na2O2,C为NaOH,D为Na2CO3;写出反应⑤的化学方程式:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(合理即可)。


科目:高中化学 来源: 题型:
【题目】甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要( )
A.快B.慢C.相等D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示已知[
随pH的变化如图所示已知[![]() ]。
]。
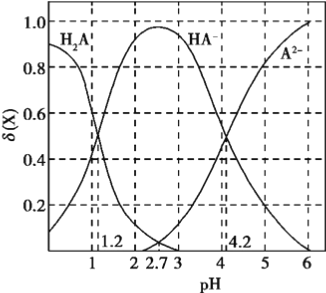
下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-)>c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)═2C(g)+D(g),2min后B的浓度减少0.6molL﹣1.对2min内反应速率的表示正确的是( )
A. 用A表示的反应速率是0.3molL﹣1min﹣1
B. 分别用B、C、D表示的反应速率其比值为3:2:1
C. 在2min末的反应速率,用B表示是0.3molL﹣1min﹣1
D. 在2min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组将含硫化氢的工业废气进行了资源化利用,将获得的电能用于制取“84”消毒液。已知:2H2S(g)+O2(g)= S2(s)+2H2O(1)ΔH=-632kJ·mol-1。下图为该小组设计的原理图。下列说法正确的是

A. 电极a 为燃料电池正极
B. 电极b上发生的电极反应为:O2+4e-+2H2O= 4OH-
C. 电路中每流过4mol 电子,电池内部释放热能小于632 kJ
D. a极每增重32g,导气管e 将收集到气体22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关我们熟知的有机物说法不正确的是
A. 乙酸可与NaHCO3(aq)反应产生CO2
B. 常温常压下甲醛、一氯甲烷、氯乙烯均为气体
C. α-氨基酸中甘氨酸与丙氨酸缩合最多可形成四种二肽
D. 乙酸乙酯和食用植物油均可水解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此时该溶液中由水电离的c(OH-)=____________。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某醛的分子式为C5H10O,其属于醛类的同分异构体种数为______种;写出属于酮的三种同分异构体:________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 硫酸铁中加入少量氨水:Fe3++3OH-=Fe(OH)3↓
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D. 将铝投入CuSO4溶液中:Al+Cu2+=Cu+Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com