
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
分析 硫酸完全电离,溶液中c(H+)=2c(H2SO4),氢氧化钡溶液中c(OH-)=2c[Ba(OH)2],结合Kw=c(OH-)×c(H+)=10-14计算B、C选项中c(H+).
解答 解:A.硫酸完全电离,溶液中c(H+)=2c(H2SO4)=0.02mol/L;
B.氢氧化钡溶液中c(OH-)=2c[Ba(OH)2]=0.02mol/L,由Kw=c(OH-)×c(H+)=10-14,可知溶液中c(H+)=$\frac{1{0}^{-14}}{0.02}$mol/L=5×10-13mol/L;
C.由Kw=c(OH-)×c(H+)=10-14,可知溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=1×10-3mol/L;
D.c(H+)=1×10-12mol•L-1的溶液.
可知0.01mol•L-1的Ba(OH)2溶液中c(H+)最小,
故选:B.
点评 本题考查物质的量浓度计算、水的离子积等,意理解电解质浓度与电解质离子的浓度的关系,会进行有关水的离子积的简单计算.


科目:高中化学 来源: 题型:选择题
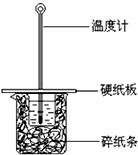 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周 期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | E | G | H | |||||
| 3 | A | C | D | I | K | |||
| 4 | B | J |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4N03是离子化合物,KN03是共价化合物 | |
| B. | NH4N03是共价化合物,KN03是离子化合物 | |
| C. | NH4N03和KN03都是离子化合物 | |
| D. | NH4N03和KN03都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
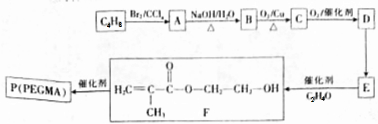
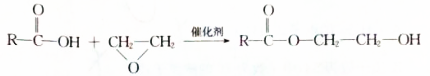
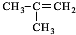 .
.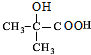 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$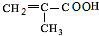 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.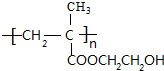 .
.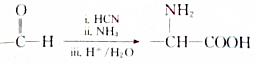 .设计由B合成
.设计由B合成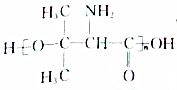 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加金属钠,有气体产生的是乙醇 | |
| B. | 加水,互溶的是乙醇 | |
| C. | 点燃,容易燃烧的是乙醇 | |
| D. | 和浓硫酸混合共热至170℃,有乙烯产生的是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的二元弱酸H2R溶液与p=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=(Na+) | |
| B. | 若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=(H+)=1×10-9mol•L-1 | |
| C. | 0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 0.1mol•L-1Na2S与0.1mol•L-1NaHS等体积混合:3c(Na+)-2c(HS-)=2c(S2-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

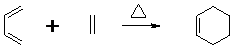
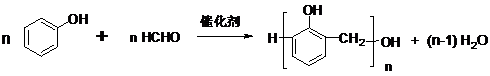
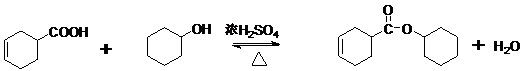
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com