
����Ŀ��I���������( K2FeO4)������һ�������ˮ�����������Ҹ�����ص�����Ҳ�ڽ����С���ͼ�Ǹ�����ص�ģ��ʵ��װ�ã�
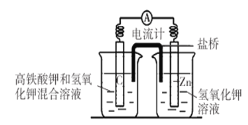
��1���õ�طŵ�ʱ�����ĵ缫��ӦʽΪ_________________________________________����ά�ֵ���ǿ��Ϊ1A����ع���ʮ���ӣ���������Zn_______g����֪F=96500C��mol,С�������1λ����
��2��������ʢ�б���KC1��Һ������������������_______�ƶ�������ҡ��������������ӽ���Ĥ�������ţ����������_______�ƶ�������ҡ�����
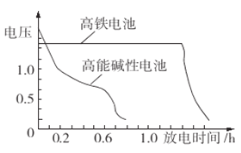
��3����ͼΪ������غͳ��õĸ��ܼ��Ե�صķŵ����ߣ��ɴ˿ɵó�������ص��ŵ���____��
��ҵ��ʪ���Ʊ�K2FeO4�Ĺ���������ͼ��
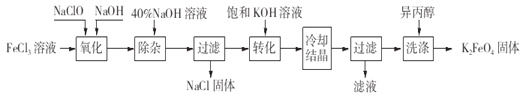
��4����ɡ������������з�Ӧ�Ļ�ѧ����ʽ��___FeCl3+___NaOH+___NaClO=___Na2FeO4+___NaCl+___H2O,������������_______���ѧʽ����
��5�����뱥��KOH��Һ��Ŀ����_____________________��
��6����֪25��ʱKsp[Fe(OH)3]=4.0��10-38�����¶�������ʵ����������5mol/L l00mL FeCl3��Һ��Ϊʹ���ƹ����в����ֻ���������������Ҫ����_______mL 2 mol/L�����ᣨ���Լ��������������
���𰸡�FeO42��+4H2O+3e��=Fe��OH��3��+5OH��0.2����ʹ��ʱ�䳤��������ѹ�ȶ�2103295NaClO��С������ص��ܽ⣬�ٽ�������ؾ�������2.5
��������
����(1)���ݵ��װ�ã�Zn��������CΪ������������ص������Ժ�ǿ�������ϸ�����ط�����ԭ��Ӧ����Fe(OH)3�������缫��ӦʽΪ��FeO42-+4H2O+3e-�TFe(OH)3��+5OH-����ά�ֵ���ǿ��Ϊ1A����ع���ʮ���ӣ�ͨ������Ϊ![]() ������������ZnΪ
������������ZnΪ![]() ��
��![]() ��65g/mol=0.2g���ʴ�Ϊ��FeO42-+4H2O+3e-�TFe(OH)3��+5OH-��0.2��
��65g/mol=0.2g���ʴ�Ϊ��FeO42-+4H2O+3e-�TFe(OH)3��+5OH-��0.2��
(2)�����������������ƶ����������������ʹ������������һ��ͨ·��ʹ����Һ���ֵ����ԣ���ƽ���ɣ����ɱպϻ�·���ŵ�ʱ�����������������ƶ�����ij�ָ߷��Ӳ����Ƴ������ӽ���Ĥ�������ţ�������������ƶ����ʴ�Ϊ���ң���
(3)��ͼ��֪������ص��ŵ��У�ʹ��ʱ�䳤��������ѹ�ȶ����ʴ�Ϊ��ʹ��ʱ�䳤��������ѹ�ȶ���
���Ȼ�����Һ�м���������ƺ��������ƣ�������ӦΪ��2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O����Na2FeO4�ֲ�Ʒ��40%KOH��Һ���ܽ⣬���˳�ȥ����NaCl�����뱥��KOH��Һ��Na2FeO4ת��Ϊ�ܽ�ȸ�С��K2FeO4����Ӧ����ʽΪNa2FeO4+2KOH=K2FeO4+2NaOH����ȴ�ᾧ�����ˣ��������������ˮ��������������������������ˮϴ�Ӳ�Ʒ���Լ��ٸ�����ص���ģ�ͬʱϴȥ������ؾ�������KOH���������ʣ��õ�����Ʒ������ء�
(4)����FeԪ�ػ��ϼ���+3������Ϊ+6�ۣ�������3�ۣ�ClԪ�ػ��ϼ���+1�۽���Ϊ-1���ۣ�������2�ۣ����ϼ�������С������Ϊ6����FeCl3��ϵ��Ϊ2��NaClO��ϵ��Ϊ3���ٸ���ԭ���غ���ƽ��Ӧ����ʽΪ��2FeCl3+10NaOH+3NaClO�T2Na2FeO4+9NaCl+5H2O������Ԫ�ػ��ϼ۽��͵ķ�Ӧ������������NaClO�����������ʴ�Ϊ��2��10��3��2��9��5��NaClO��
(5)���뱥��KOH��Һ��������K+��Ũ�ȣ���С������ص��ܽ⣬�ٽ�������ؾ����������ʴ�Ϊ����С������ص��ܽ⣬�ٽ�������ؾ���������
(6)��Һ��c(Fe3+)=5mol/L������Ksp[Fe(OH)3]=c(Fe3+)��c3(OH-)=4.0��10-38����֪��ʼ����ʱc(OH-)=2��10-13mol/L������Һ��c(H+)=![]() mol/L=0.05mol/L������ϡ�Ͷ��ɣ���Ҫ��������
mol/L=0.05mol/L������ϡ�Ͷ��ɣ���Ҫ��������![]() =2.5mL���ʴ�Ϊ��2.5��
=2.5mL���ʴ�Ϊ��2.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��F����ѧ��ѧ�г������ʣ�����A��C��EΪ���壬��A��ʹƷ����Һ��ɫ��B��DΪҺ�壬D��Ũ��Һ�ڳ�������ʹ���ۻ���F��Ũ��Һ��X����ͨ������ʵ�����Ʊ�����C��X��һ�ֺ�ɫ��ĩ��B��������18�����ӡ�(��Ӧ�в�������������ȥ��
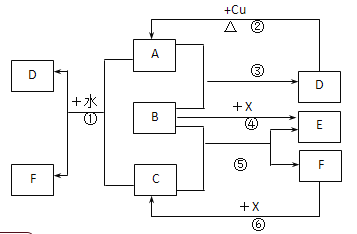
(1)д����Ӧ�ڵĻ�ѧ����ʽ��___________________��
(2)д����Ӧ�١��ݵ����ӷ���ʽ����____________����________________��
(3)����ͼ����Ϣ��B��C��D��X�����Դ�ǿ������˳����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��Na+��Cu2+��Ba2+��Fe3+��AlO2-��CO32-��SO42-��Cl-�е�������������ɣ�ȡ��������Һ��������ʵ�飺����˵����ȷ����
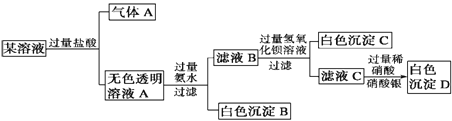
A. ԭ��Һ��һ��ֻ����AlO2-��CO32-��SO42-��Cl- ��������
B. ����A�Ļ�ѧʽ��CO
C. ԭ��Һ��һ�������ڵ�������Cu2+��Ba2+��Fe3+
D. ���ɳ���B�����ӷ���ʽΪ��Al3++ 3OH- = Al(OH)3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨNa2CO3��Na2SO3������и���ֵĺ������������ʵ�鷽����
��1������һ����ȡһ����������Ʒ(30g)�����������м��������أ���ȴ����ȡʣ���������Ϊ31.6g�����㡣��ʵ���м��������ص�Ŀ����_________________________������Ʒ��Na2CO3����������Ϊ_______________________________
��2��������������ͼ��ʾװ�ý���ʵ�飺������̨�����е�����δ��ͼ�л�����
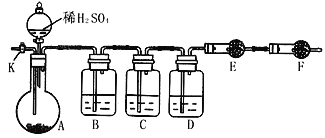
����֪����C��װ��Ʒ����Һ����������______________�������������Һ��������Na2CO3�����IJ��������ʵ��ֵƫ�ͣ�������____________________��
��ʵ�����б������³����Լ���a.Ũ���� b.Ʒ����Һ c.���Ը��������Һd.����������Һ e.��ˮ����ͭ f.��ʯ�� g.���������� h.��ˮ�Ȼ��� �뽫����������Ӧʢ�ŵ��Լ����������Ӧ�ո�B��______��D��________��E��________��
��ʵ������У�������A�ڵĹ��巴Ӧ��ȫ�������K����A��ͨ������ĵ�������������Ŀ����______________��
��3������������ȡһ������Ʒ������С�ձ��У�������ˮ�ܽ⣬��С�ձ��м�������BaCl2��Һ�����ˡ�ϴ�ӡ������������������������ʵ�����жϳ���ϴ�ɾ��ķ�����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����[��FeCl3,Fe(OH)3,Na2FeO4��]��������������Ӧ�ù㷺��������ѧ֪ʶ���ش����⣺
��1�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壬����FeCl3��Һ��Fe3+���ڵij����Լ���_______��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ����Ӧ�����ӷ���ʽΪ________________�����Ӹ�ʴ��ķ�Һ�л���Cu�����»��FeCl3��Һ�����������Լ������������ۢ�Ũ�����������ռ�ް�ˮ����ѡ���Լ�______��д����Ӧ�����ӷ���ʽ����Һ�л���Cu_________����Һ���»��FeCl3��Һ_________��
��2����ˮ����μ���1mol/L FeCl3��Һ��������������Һ�����ĺ��ɫ���÷�Ӧ�Ļ�ѧ����ʽΪ____���÷�ɢϵ�з�ɢ�ʵ���ֱ��Ϊ____ nm��
��3����������Na2FeO4��һ�����;�ˮ��������ͨ�����·�Ӧ�Ƶ�2Fe(OH)3+3NaClO+4NaOH��2Na2FeO4+3X+5H2O��X�Ļ�ѧʽΪ____���ӻ��ϼ������Ƕȿ��ǣ����������ܹ�ɱ������Ϊ������____�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɫ����Һ�У�һ���ܴ���������ǣ� ��
A.����0.1mol/L Ba2+����Һ�У�Na+��K+��HCO3-��Cl-
B.�ڰ�ˮ�У�K+��Cu2+��Cl-��SO42-
C.ǿ������Һ�У�Fe3+��MnO4-��SO42-��K+
D.ǿ������Һ�У�Na+��Fe2+��Cr2O72-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������мȿ���Ũ�������ֿ��ù����������Ƹ������(����)
A.Cl2B.O2
C.SO2D.NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ǻ�ͬʱ����ͬһ̼ԭ���ϵĽṹ�Dz��ȶ��ģ���Ҫ������ˮ��Ӧ��

���з���ʽΪC9H8O2X2��XΪһδ֪Ԫ�أ�������M������һ�������·�������һϵ�з�Ӧ
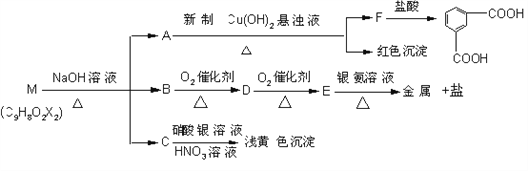
�Իش��������⣺
��1��XΪ____________________����Ԫ�ط��ţ���
��2������ת������������������Ӧ�Ĺ���_______���������֣���M��NaOH��Һ���ȷ�Ӧ������������_______________ ��Ӧ��
��3��M�Ľṹ��ʽΪ ________________________________
��4��д�����з�Ӧ�Ļ�ѧ���̣�
E��������Һ��Ӧ�Ļ�ѧ����ʽ��_______________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
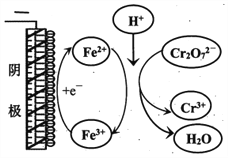
����Ŀ���о�+6�۸��β�ͬ��������������ʽ�������ԣ�ijС��ͬѧ��������ʵ�飺
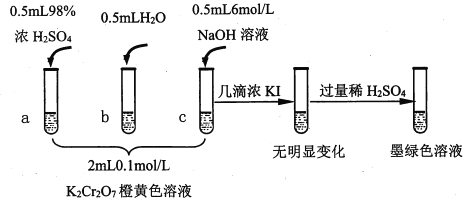
��֪��Cr2O72- (��ɫ)+H2O![]() 2CrO42-(��ɫ)+2H+ ��H= +13.8 kJ/mol��+6�۸�����һ�������¿ɱ���ԭΪCr3+��Cr3+��ˮ��Һ��Ϊ��ɫ��
2CrO42-(��ɫ)+2H+ ��H= +13.8 kJ/mol��+6�۸�����һ�������¿ɱ���ԭΪCr3+��Cr3+��ˮ��Һ��Ϊ��ɫ��
��1���Թ�c��b�Աȣ��Ʋ��Թ�c��������________��
��2���Թ�a��b�Աȣ�a����Һ��ɫ�������Ϊ�¶�Ҳ��Ӱ��ƽ����ƶ�����ɫ���һ����c(H+)����Ӱ��Ľ��������Ϊ��ɫ����һ����c(H+)�����ƽ���Ӱ�졣����Ϊ�Ƿ���Ҫ�����ʵ��֤����____�����ǡ�����������_________________________________��
��3���Ա��Թ�a��b��c��ʵ�����õ��Ľ�����________________��
��4���Թ�c�����μ�KI��Һ������ϡH2SO4��������ͼ��ʵ�����ó��Ľ�����_______��д���˹�����������ԭ��Ӧ�����ӷ���ʽ________________��
��5��С��ͬѧ�õ�ⷨ������Cr2O72-��ˮ��̽����ͬ���ضԺ�Cr2O72-��ˮ������Ӱ�죬������±���ʾ��Cr2O72-����ʼŨ�ȣ��������ѹ�����ʱ�����ͬ����
ʵ�� | �� | �� | �� | �� |
�Ƿ����Fe2(SO4)3 | �� | �� | ����5g | �� |
�Ƿ����H2SO4 | �� | ����1mL | ����1mL | ����1mL |
�缫���� | ����������Ϊʯī | ����������Ϊʯī | ����������Ϊʯī | ����Ϊʯī������Ϊ�� |
Cr2O72-��ȥ����/% | 0.922 | 12.7 | 20.8 | 57.3 |
��ʵ������Cr2O72-�ŵ�ĵ缫��Ӧʽ��________________��
��ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com