
| A. | 0.4mol | B. | 0.5mol | C. | 0.6mol | D. | 0.8mol |
分析 加入0.1mol Cu2(OH)2CO3能使电解后的溶液恢复原状,加入的 Cu2(OH)2CO3相当于2CuO.H2O.CO2,实际上加入的物质相当于0.1mol (2CuO.H2O),阴极上析出Cu、H2,阳极上只析出O2,根据O原子和转移电子子之间的关系式计算转移电子物质的量.
解答 解:加入0.1mol Cu2(OH)2CO3能使电解后的溶液恢复原状,加入的 Cu2(OH)2CO3相当于2CuO.H2O.CO2,实际上加入的物质相当于0.1mol (2CuO.H2O),阴极上析出Cu、H2,阳极上只析出O2,阳极上转移电子的物质的量=0.1mol×3[0.1mol (2CuO.H2O)中O原子个数]×2=0.6mol,故选C.
点评 本题以物质的量的计算为载体考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确“析出什么加入什么”原则是解本题关键,注意各个电极上放电的离子,题目难度中等.


科目:高中化学 来源: 题型:选择题
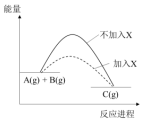
| A. | 反应速率增大 | B. | 反应物转化率增大 | ||
| C. | 生成物的能量降低 | D. | 反应的热效应降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排水法收集铜粉与浓硝酸反应产生的NO2 | |
| B. | 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 用饱和NaHCO3溶液除去Cl2中混有的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
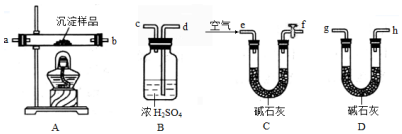
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硫酸共热有气体放出 | |
| B. | 用玻璃棒蘸浓硫酸滴在白纸上,白纸变黑 | |
| C. | 把木炭放入热的浓硫酸中,有气体放出 | |
| D. | 常温下可用铁、铝制容器盛装冷的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离乙酸乙酯和水 | |
| D. | 淀粉溶液与硫酸共热后,加入新制氢氧化铜加热,无砖红色沉淀生成,说明淀粉没有水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com