
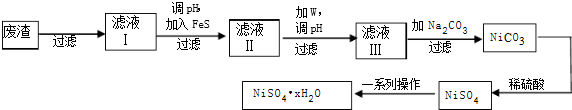
| ||
| ||


科目:高中化学 来源: 题型:
| A、用NaOH溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| B、用丁达尔效应鉴别碳酸溶液和硅酸溶胶 |
| C、用焰色反应鉴别KCl和KNO3 |
| D、用澄清石灰水鉴别SO2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | 1 | 2 | 3 |
| 混合物的质量g | 3.38 | 5.07 | 6.76 |
| 硫酸溶液的体积ml | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量mol | 0.03 | 0.035 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
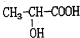 下列有关乳酸的说法不正确的是( )
下列有关乳酸的说法不正确的是( )| A、乳酸中能发生酯化反应的官能团有2种 |
| B、1mol乳酸可与2mol NaOH发生中和反应 |
| C、1mol乳酸与足量金属Na反应生成生成1mol H2 |
D、有机物与 与乳酸互为同分异构体 与乳酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y的单质间形成的化合物的化学式可能是Y2X或Y2X2 |
| B、元素X形成的化合物的种类比元素Y形成的化合物种类多 |
| C、Y的单质与硫酸铜溶液反应时有气体放出并有蓝色沉淀生成 |
| D、X和Y在自然界中只能以化合态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、线型高分子的结构由不带支链的长链分子组成 |
| B、体型高分子是一种网状结构 |
| C、高分子材料的强度主要由分子间的作用力决定 |
| D、体型高分子是由高分子链间形成化学键而交联成空间网状结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢铵 |
| B、草木灰(K2CO3,其水溶液成强碱性) |
| C、过磷酸钙 |
| D、氯化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③⑤ |
| C、②⑥ | D、②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com