
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准液滴定待测液,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 中和热测定实验中,将碱缓慢倒入酸中,所测温度值偏小 |
分析 A.湿润的pH值试纸可以稀释碱液;
B.定容时俯视刻度线,导致溶液的体积偏小;
C.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积;
D.碱缓慢倒入酸中,不能准确测定反应的最高温度.
解答 解:A.湿润的pH值试纸可以稀释碱液,溶液中氢氧根离子根据减小,测定的溶液碱性减弱,测定值偏小,故A正确;
B.定容时俯视刻度线,导致溶液的体积偏小,溶液的物质的量浓度偏大,故B错误;
C.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积,会导致所测溶液体积偏小,故C正确;
D.碱缓慢倒入酸中,不能准确测定反应的最高温度,热量损失导致所测温度值偏小,应一次性迅速将将碱倒入酸中,故D正确;
故选B.
点评 本题考查实验基本操作、误差分析等,明确实验原理及仪器的正确使用方法是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 分别滴入几滴水,振荡,摸试管底部. | 试管a放热现象更明显(填“a”或“b”) |
| ③ | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象. | / |
| ④ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液均变红,颜色较深的试管是a(填“a”或“b”). |
| ⑤ | 最后分别向两溶液中滴加足量盐酸. | 红色褪去,均有无色气体产生.经计算生成气体的是a<b(填“>”“<”或“=”) |
| ⑥ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末)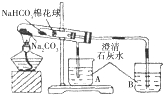 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是还原产物 | |
| C. | H2C2O4在反应中被还原 | |
| D. | 1mol H2C2O4参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
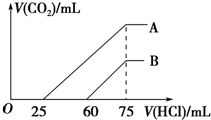 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )| A. | 在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3 | |
| B. | B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况) | |
| C. | 原NaOH溶液的物质的量浓度为0.100mol/L | |
| D. | B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油和矿物油都属于酯类物质 | |
| B. | 人们用明矾对水进行消毒、杀菌 | |
| C. | 反应 原子利用率最高 原子利用率最高 | |
| D. | 甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .某油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
.某油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
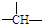 ”结构.
”结构.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com