
医学界通过用14C标记的C60发现一种羧酸衍生物,在特定条件下,它可以通过断裂DNA抑制艾滋病毒的繁殖。下列有关叙述中,正确的是
A.14C与12C的性质完全不同
B.14C与14N含有的中子数相同
C.14C60和12C60是碳元素的同素异形体
D.14C与12C、13C互为同位素
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:单选题
下列事实中,不能用于判断元素失电子能力强弱的是
| A.金属间发生的置换反应 |
| B.金属元素的最高价氧化物对应水化物的碱性强弱 |
| C.金属元素的单质与水或酸反应置换出氢气的难易 |
| D.每摩尔金属单质在反应中失去电子数目的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于d轨道的说法错误的是( )
| A.M层才开始出现d轨道 |
| B.d轨道最早出现在第4周期元素 |
| C.电子排布时,3d轨道能量高于4s轨道 |
| D.d轨道有10种空间伸展方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.金属元素不可能形成含氧酸根离子 |
| B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 |
| C.金属与非金属元素分界线附近的元素是过渡元素 |
| D.形成化合物种类最多的元素在IVA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关下列说法正确的是
| A.若原子X的质子数为a,则X的质量数一定不为a |
| B.若两种元素形成的离子M2-和N+电子层结构相同,则离子半径M2->N+ |
| C.同周期非金属氧化物对应水化物酸性从左到右依次增强 |
| D.由两种元素组成的化合物,若含有离子键,就没有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2012年诺贝尔化学奖获得者利用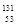 I研究G蛋白偶联受体,下列说法正确的是
I研究G蛋白偶联受体,下列说法正确的是
| A.I元素的质量数是131 | B.I元素的中子数是78 |
| C.I原子5p亚层有一个未成对电子 | D.I原子有53个能量不同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
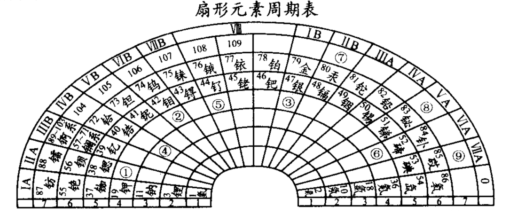
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | |
| 4 | J | | | | | | k | |
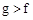
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
| A.气态氢化物的热稳定性:HnY>HnW |
| B.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| C.Y和X、Z和X组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com