
 ��ȡ0.2mol/L��NaOH��Һ��0.1mol/L��G��Һ�������Ϻ�������ַ�Ӧ���ָ������£�ʣ����Һ������Ũ���ɴ�С��˳����c��Na+����c��S2-����c��OH-����c��HS-����c��H+������ʱ�����Һ��pH=12�����������G�������ӵĵ���ƽ�ⳣ��Ka=4��10-12
��ȡ0.2mol/L��NaOH��Һ��0.1mol/L��G��Һ�������Ϻ�������ַ�Ӧ���ָ������£�ʣ����Һ������Ũ���ɴ�С��˳����c��Na+����c��S2-����c��OH-����c��HS-����c��H+������ʱ�����Һ��pH=12�����������G�������ӵĵ���ƽ�ⳣ��Ka=4��10-12���� A��B��C��D��E����Ԫ�ؾ��Ƕ����ڵ�����Ԫ�أ�ԭ��������������B��Eԭ�ӵ�������������Ϊ����Ӳ�����2������Ϊ��A�塢��A��Ԫ�أ�D��EԪ��ԭ��������������ȣ�����ͬ���壬��ԭ������D����E����ΪB�ڢ�AԪ�أ�EΪ��AԪ�أ�����BΪCԪ�أ�EΪSԪ�أ�DΪOԪ�أ�C��ԭ����������̼����֮�䣬��CΪNԪ�أ�X��Y��Z��W��G���ס����������ʾ�������Ԫ���е����ֻ�����Ԫ����ɣ�Ԫ��B�γɵĵ���MΪ̼����ס���Ũ��Һ���ܷ�Ӧ����Է����������ף��ң�������֪����ΪHNO3����ΪH2SO4������M��Ӧ����X��Y��Z������M��Ӧ����Y��Z��W����XΪNO2��WΪSO2��Y��Z�ֱ�ΪH2O��CO2�е�һ�֣�X��Y��W������Z��Ӧ����YΪCO2��ZΪH2O�����Ͽ�֪AΪHԪ�أ�Ȼ�������ʵ����ʼ���ѧ���������
��� �⣺��1������ȡNO21mol�������Ϊ22.4L������3NO2+H2O=2HNO3+NO֪��V����Һ��=22.4L��$\frac{2}{3}$�����ʵ����ʵ���Ϊ$\frac{2}{3}$mol����һ�����c��HNO3��=$\frac{\frac{2}{3}mol}{22.4L��\frac{2}{3}}$=$\frac{1}{22.4}$ mol/L=0.045 mol/L��
�ʴ�Ϊ��$\frac{1}{22.4}$ mol/L��0.045 mol/L��
��2��NO2��SO2��O2��4��4��3ͨ��ˮ�У�ǡ�÷���������ԭ��Ӧ��������������ᣬ��Ӧ�����ӷ���ʽΪ4SO2+4NO2+3O2+6H2O=12H++4SO42-+4NO3-��
�ʴ�Ϊ��4SO2+4NO2+3O2+6H2O=12H++4SO42-+4NO3-��
��3��G��һ�ּ�����ǿ��������ǿ�Ӧ����ʽ�Σ�G������Ԫ���е����ֻ�����Ԫ����ɣ���GΪNH4HS�������ʽΪ�� ��
��
ȡ0.2mol/L��NaOH��Һ��0.1mol/L��NH4HS��Һ�������Ϻ������ʵ���֮��Ϊ2��1����������ַ�Ӧ����Na2S��������ˮ�����ָ�������ʣ����ҺΪNa2S��Һ����Һ��S2-ˮ�⣬��Һ�ʼ��ԣ�ˮ�ĵ�����������������ӣ���c��OH-����c��HS-������Һ��������Ũ����С������Һ��c��Na+����c��S2-����c��OH-����c��HS-����c��H+����
��ʱ�����Һ��PH=12��c��H+��=10-12mol/L��c��OH-��=10-2mol/L������S2-+H2O?OH-+HS-����Һ������������Դ��������ˮ�⼰ˮ�ĵ��룬����Һ��c��HS-��=10-2mol/L-10-12mol/L��10-2mol/L����Һ��c��S2-��=0.1mol/L��$\frac{1}{2}$-10-2mol/L=0.04molL����HS-=S2-+H+����֪��������Ka=$\frac{c��{S}^{2-}����c��{H}^{+}��}{c��H{S}^{-}��}$=$\frac{0.04��1{0}^{-12}}{1{0}^{-2}}$=4��10-12��
�ʴ�Ϊ�� ��c��Na+����c��S2-����c��OH-����c��HS-����c��H+����4��10-12��
��c��Na+����c��S2-����c��OH-����c��HS-����c��H+����4��10-12��
��4����S�γɵĵ��������ȵ�ŨNaOH��Һ��Ӧ�������־��л�ԭ�Ե��Σ�Ϊ�ڼ��������������绯��Ӧ���������ƺ��������ƣ���Ӧ�ķ���ʽΪ3S+6NaOH=2Na2S+Na2SO3+3H2O����Ӧ��SԪ�ػ��ϼ���0�۷ֱ�仯Ϊ-2�ۡ�+4�ۣ��ɵ�ʧ������ȿ�֪�������ͻ�ԭ����������Ϊ2��1��
�ʴ�Ϊ��3S+6NaOH=2Na2S+Na2SO3+3H2O��2��1��
���� ���⿼�������ƶϣ�Ԫ�ص��ƶϼ����ʵ��ƶ�Ϊ�����Ĺؼ�����Ҫѧ����������Ԫ�ػ�����֪ʶ����3���м���Ϊ�״��㣬������Ϊ�����������������Ũ����ȣ�ע����Լ��㣬�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2���л�ԭ�ԣ�������Ư��ֽ�� | |
| B�� | ��ʯ�Ҿ�����ˮ�ԣ������ڸ������� | |
| C�� | �������������ԣ�������ʴ�̲��� | |
| D�� | H2O2���л�ԭ�ԣ������������Ը��������Һ��Ӧ��ȡ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ʊ�������������ʱ�������������������Ũ����Һʱ��ֻ��С���������Һ��ȫ������ | |
| B�� | ��1 mLŨ�Ⱦ�Ϊ0.05 mol•L-1��NaCl��NaI�����Һ�еμ�2��0.01 mol•L-1��AgNO3��Һ���������ʻ�ɫ�����ۣ�Ksp��AgCl����Ksp��AgI�� | |
| C�� | 0.1mol•L-1��NaOH��Һ�ֱ��к�pH���������ȵĴ�������ᣬ������NaOH��Һ�������ǰ��С�ں��� | |
| D�� | ˮ�ĵ�����������ȹ��̣������¶ȣ�ˮ�����ӻ�����pH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �� ����������Ӧ�IJ��
�� ����������Ӧ�IJ�� ��
�� ��
�� ����һ�֣�
����һ�֣� ��R-ONa$��_{��}^{Cl-R��}$R-O-R�䣨R-��R��-��������
��R-ONa$��_{��}^{Cl-R��}$R-O-R�䣨R-��R��-��������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 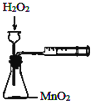 �����ⶨ��ѧ��Ӧ���� | B�� | 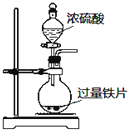 �����Ƭ��Ũ����ķ�Ӧ | ||
| C�� |  ��ʳ��ˮ����ȡNaCl | D�� | 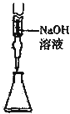 ��ȡ15.00mLNaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1.0mol CH4��2.0mol H2O��g��ͨ���ݻ�Ϊ10L�ķ�Ӧ������ һ�������·�����ӦI�������һ��ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ������100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.03mol•L-1•min-1��
��1.0mol CH4��2.0mol H2O��g��ͨ���ݻ�Ϊ10L�ķ�Ӧ������ һ�������·�����ӦI�������һ��ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ������100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.03mol•L-1•min-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ʿ��û����ǽ������� | B�� | ��������Ԫ�ز�һ����ͬ����Ԫ�� | ||
| C�� | ���ʿ�ͬΪ��̬��Ҳ��ͬΪ��̬ | D�� | �����ڳ����½��з�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 28 g��C2H4��C3H6��ɵĻ�����к�����ԭ�ӵ���ĿΪ4 NA | |
| B�� | l mol Fe��NO3��3������HI��Һ��Ӧʱת�Ƶĵ�����Ϊ3NA | |
| C�� | 1 mol Na2O2�����к���������Ϊ4NA | |
| D�� | �ڱ�״���£�11.2L NO2����������Ϊ11.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com