
����Ŀ���������������Ħ���Σ���ѧʽΪx��NH4��2SO4yFeSO4zH2O����������ˮ������ȱ����ƶѪ�ȣ�ijʵ��С����������ķ������ⶨ����ɣ�
��NH4+�����ⶨ����ȡ9.8g��������茶��壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ�������lO%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������lOOmL 1.0molL��1���������Һ���գ�
����������ȡ�½���ƿ����1.0molL��1NaOH����Һ�ζ�ʣ���HCl�����յ�ʱ����50mlNaOH��Һ��
��Fe2+�����ⶨ��������ʵ��������ƿ�м��������3%��˫��ˮ����ַ�Ӧ����ˡ�ϴ�ӡ����յõ�2.0g���壮
�۽ᾧˮ�����ⶨ����ȡ9.8g��������茶��壬������Ϊ15g�������м�����200�棬����һ��ʱ�䣬���ڿ�������ȴ����������Ϊ22.3g���ظ��������ȡ���ȴ���������̣��������γ��������ͬ���ش��������⣺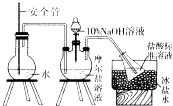
��1��װ���а�ȫ�ܵ�����ԭ���� ��
��2������ˮ�������� ��
��3����NaOH����Һ�ζ�ʣ���HClʱ����ʹ�õ�ָʾ���� ��
��4���ⶨFe2+ʱ������˫��ˮ������Ӧ�Ļ�ѧ����ʽ�� ��
��5������ڲⶨNH4+�����Ĺ����У�����Ԫ�ز��ֱ���������Fe2+�����IJⶨ����С����ޡ���Ӱ�죮
��6�����ݢ١��ڵ����ݣ���Ħ���ξ�����n��NH4+����n��Fe2+����n��SO42�� ��= �� z= ��
��7�����ݢ۵����ݣ����ֽᾧˮ�����ⶨ���ƫ�ͣ���ʵ����̷���������ԭ���� ��
���𰸡�
��1����������ƿ��ѹ������ʱ����ȫ����Һ��������ʹ������ƿƿ��ѹ���ȶ�
��2����ֹ����ӷ�
��3�����Ȼ��̪
��4��2Fe��OH��2+H2O2=2Fe��OH��3
��5����
��6��2��1��2��6
��7����ˮ�����ڿ�������ȴʱ�����˿�����ˮ����
���������⣺��1��������ƿ��Բ����ƿ��ͨ����������ƿ��ѹ������ʱ����ȫ����Һ��������ʹ������ƿƿ��ѹ���ȶ������Դ��ǣ���������ƿ��ѹ������ʱ����ȫ����Һ��������ʹ������ƿƿ��ѹ���ȶ�����2������ˮ�¶Ƚϵͣ�������ȴ��ƿ�е��������Һ����ֹ����ӷ������Դ��ǣ���ֹ����ӷ�����3��ǿ��ζ�ǿ������ü��Ȼ��̪��ָʾ����������NaOH����Һ�ζ�ʣ���HClʱ������ʹ�ü��Ȼ��̪��ָʾ�������Դ��ǣ����Ȼ��̪����4����˫��ˮ��Fe��OH��2������ΪFe��OH��3 �� �䷴Ӧ�ķ���ʽΪ��2Fe��OH��2+H2O2=2Fe��OH��3 �� ���Դ��ǣ�2Fe��OH��2+H2O2=2Fe��OH��3����5���ⶨFe2+�ĺ������ǰ�Fe2+ת��Ϊ���������������յõ���������������Ԫ���غ���㣬�����ڲⶨNH4+�����Ĺ����У�����Ԫ�ز��ֱ���������Fe2+�����IJⶨ��Ӱ�죬���Դ��ǣ��ޣ���6����1.0molL��1NaOH����Һ�ζ�ʣ���HCl�����յ�ʱ����50mlNaOH��Һ������������ʵ���n��HCl��=n��NaOH��=1.0molL��1��0.05L=0.05mol���백����Ӧ������Ϊ1.0molL��1��0.1L��0.05mol=0.05mol�������������ʵ���Ϊ0.05mol����n��NH4+��=0.05mol��
n��Fe2+��=2n��Fe2O3��=2�� ![]() =0.025mol��n��SO42�� ��=
=0.025mol��n��SO42�� ��= ![]() n��NH4+��+n��Fe2+��=
n��NH4+��+n��Fe2+��= ![]() ��0.05mol+0.025mol=0.05mol������n��NH4+����n��Fe2+����n��SO42�� ��=0.05mol��0.025mol��0.05mol=2��1��2����������ݿ�֪9.8gĦ������m��H2O��=9.8g��m��NH4+����m��Fe2+����m��SO42����=9.8g��18��0.05g��56��0.025g��96��0.05g=2.7g����n��H2O��=
��0.05mol+0.025mol=0.05mol������n��NH4+����n��Fe2+����n��SO42�� ��=0.05mol��0.025mol��0.05mol=2��1��2����������ݿ�֪9.8gĦ������m��H2O��=9.8g��m��NH4+����m��Fe2+����m��SO42����=9.8g��18��0.05g��56��0.025g��96��0.05g=2.7g����n��H2O��= ![]() =0.15mol������
=0.15mol������ ![]() =
= ![]() �����z=6�����Դ��ǣ�2��1��2��6����7���ɢ������ݿ�֪m��H2O��=9.8g+15g��22.3g=2.5g���ɢ٢ڼ���õ���ˮ������Ϊ2.7g���ᾧˮ�����ⶨ���ƫ�ͣ���Ϊ�����������м��Ⱥ��ڿ�������ȴʱ�������ˮ������ʣ����������ƫ���������ˮ������ƫС��
�����z=6�����Դ��ǣ�2��1��2��6����7���ɢ������ݿ�֪m��H2O��=9.8g+15g��22.3g=2.5g���ɢ٢ڼ���õ���ˮ������Ϊ2.7g���ᾧˮ�����ⶨ���ƫ�ͣ���Ϊ�����������м��Ⱥ��ڿ�������ȴʱ�������ˮ������ʣ����������ƫ���������ˮ������ƫС��
���Դ��ǣ���ˮ�����ڿ�������ȴʱ�����˿�����ˮ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L���ܱ������з������·�Ӧ��A(s)��2B(g)![]() 2C(g) ��H<0����Ӧ������B��C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ1����Ӧ��ƽ�����t1��t2��t3��t4ʱ�ֱ�ֻ�ı���һ���������淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ2.�����й�˵����ȷ����
2C(g) ��H<0����Ӧ������B��C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ1����Ӧ��ƽ�����t1��t2��t3��t4ʱ�ֱ�ֻ�ı���һ���������淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ2.�����й�˵����ȷ����

A. ��Ӧ��ʼ2 min�ڣ�v(B)��0.1 mol/(L��min)
B. t1ʱ�ı�����������������¶�
C. t3ʱ�ı�����������Ǽ�ѹ����ʱc(B)����
D. t4ʱ������ʹ���˴�������ʱc(B)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������д������
A. ��ȼ���鲻һ���ᱬը
B. ����ȼ�շų��������ȣ�������һ�ֺܺõ�����ȼ��
C. ú��Ŀ�Ҫע��ͨ�粢�Ͻ��̻��Է���ը�ķ���
D. ��ȼ����ǰ���ؽ����鴿
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������������ȷ���ǣ� ��
A.1molO2��H2�Ļ�������к��еķ�����ΪNA
B.1.7g NH3����ԭ����Ϊ0.1NA
C.ͨ��״���£�11.2L N2�к��е�ԭ����ĿΪNA
D.��״���£�22.4L H2O�к��е���ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʰ��ᡢ����������е���
A. ���ᡢ̼���ơ������� B. ���ᡢ�ռ����
C. �������ơ���ʯ�ҡ������� D. ���ᡢ��ʯ�ҡ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ�����CuSO4��5H2O����˵���д������
A. �����ڴ����� B. ������������
C. ������ͭ�� D. �����ڻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������BaCl2��Һ���뵽250ml̼���ƺ������ƵĻ����Һ�У���ַ�Ӧ���ˡ�ϴ�ӡ������õ�6.27g������������м������������������壬�����2.33g�������ܣ�
��1�������������Һ�����ʵ���Ũ�ȣ�
��2��������м�������������ַ�Ӧ�������ղ����������ڱ�״���µ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������������ȡ������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3 �� �������������ʣ� ��ȡ��ˮ������������FeSO47H2O����������������̣�  ����˵������ȷ���ǣ� ��
����˵������ȷ���ǣ� ��
A.�ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B.����1��һ������SiO2 �� ����pH��Ϊ��ʹAl3+ת��ΪAl��OH��3 �� �������2
C.����Һ2�õ�FeSO47H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
D.���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO47H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ�����pH��12��Ba(OH)2��Һ�У���μ���һ�����ʵ���Ũ�ȵ�NaHSO4��Һ������Һ�е�Ba2��ǡ����ȫ����ʱ����Һ��pH��11������Ӧ����Һ���������Ba(OH)2��Һ��NaHSO4��Һ�����֮�ͣ���Ba(OH)2��Һ��NaHSO4��Һ���������
A. 1��9 B. 1��1 C. 1��2 D. 1��4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com