
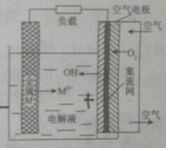
 金属燃料电池是一类特殊的燃料电池.具有成本低、无毒、无污染、比功率高、比能量高等优点,电池的基本结构如图,锌、铁、镁、铝等金属都可以用在金属燃料电池中.下列说法不正确的是( )
金属燃料电池是一类特殊的燃料电池.具有成本低、无毒、无污染、比功率高、比能量高等优点,电池的基本结构如图,锌、铁、镁、铝等金属都可以用在金属燃料电池中.下列说法不正确的是( )| A. | 电池工作时.金属M电极皱氧化.发生氧化反应 | |
| B. | 电池工作时.空气电极反应式为O2+4e-+2H2O=4OH | |
| C. | 电池工作时.OH-向负极移动,负极附近溶液的pH增大 | |
| D. | 若M为锌,电池反应方程式为2Zn+2H2O+O2=2Zn(OH)2 |
分析 该原电池中,金属失电子发生氧化反应,所以M为负极、空气电极为正极,
A.电池工作时,金属M电极失电子发生氧化反应被氧化;
B.电池工作时,空气电极得电子发生还原反应;
C.电池工作时,OH-向负极移动,与金属离子结合成沉淀;
D.若M为锌,发生吸氧腐蚀,电池反应方程式为2Zn+2H2O+O2=2Zn(OH)2.
解答 解:A.该装置是原电池,金属M电极失电子发生氧化反应被氧化,故A正确;
B.电池工作时,空气电极得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故B正确;
C.电池工作时,OH-向负极移动,与金属离子结合成沉淀,溶液的pH不变,故C错误;
D.若M为锌,发生吸氧腐蚀,电池反应方程式为2Zn+2H2O+O2=2Zn(OH)2,故D正确;
故选C.
点评 本题考查化学电源新型电池,侧重考查原电池原理,明确各个电极上发生的电极反应是解本题关键,会书写电极反应式,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 因为K的活泼性强,所以钾应该保存在煤油中 | |
| B. | K在空气中点燃,产物只有K2O | |
| C. | K 与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气 | |
| D. | K可以和CuSO4溶液发生置换反应,置换出Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
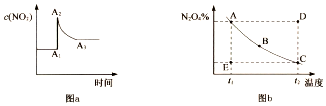
| A. | 其它条件不变时,向平衡体系中充入N2O4,平衡常数增大 | |
| B. | 图a中,A1一A2变化的原因一定是充人了NO2 | |
| C. | 图b中,E点对应状态中,v(正)>v(逆) | |
| D. | 图b中,E→A所需时间为x,D→C所需时间为y,则x<y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 石灰石与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Cl2通入水中:Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
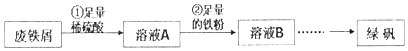
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
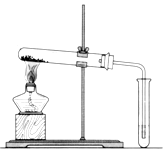 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com