
 1Lij»ģŗĻČÜŅŗ£¬æÉÄÜŗ¬ÓŠµÄĄė×ÓČē±ķ£ŗ
1Lij»ģŗĻČÜŅŗ£¬æÉÄÜŗ¬ÓŠµÄĄė×ÓČē±ķ£ŗ| æÉÄÜ“óĮæŗ¬ÓŠµÄŃōĄė×Ó | H+”¢K+”¢Mg2+”¢Al3+”¢NH4+”¢Fe2+”¢Fe3+ |
| æÉÄÜ“óĮæŗ¬ÓŠµÄŅõĄė×Ó | Cl-”¢Br-”¢I-”¢CO32-”¢AlO2- |
| Cl2µÄĢå»ż£Ø±ź×¼×“æö£© | 2.8L | 5.6L | 11.2L |
| n£ØCl-£© | 1.25mol | 1.5mol | 2mol |
| n£ØBr-£© | 1.5mol | 1.4mol | 0.9mol |
| N£ØI-£© | a mol | 0 | 0 |
·ÖĪö £Ø1£©£Ø2£©ĶłøĆČÜŅŗÖŠÖšµĪ¼ÓČėNaOHČÜŅŗ£¬æŖŹ¼²śÉś³ĮµķµÄĪļÖŹµÄĮæĪŖ0£¬¹ŹŅ»¶Øŗ¬ÓŠH+£¬ÄĒĆ“Ņ»¶Ø²»ÄÜŗ¬ÓŠCO32-”¢AlO2-£¬V1-V2¶ĪÉś³É³Įµķ£¬ĒŅ³ĮµķŌŚV3-V4¶ĪČ«²æČܽā£¬¹ŹČÜŅŗÖŠŅ»¶Øŗ¬ÓŠAl3+£¬Ņ»¶Ø²»ÄÜŗ¬ÓŠMg2+”¢Fe2+”¢Fe3+£¬V2-V3¶Ī³öĻÖ³Įµķ²»¼õÉŁ£¬µ«ŹĒĻūŗÄNaOHČÜŅŗ£¬¹ŹŅ»¶Øŗ¬ÓŠNH4+£¬ŅŌ“Ė½ā“š£»
£Ø3£©¢ŁµāĄė×ÓÓėäåĄė×ӵĻ¹ŌŠŌĒæČõĖ³ŠņĪŖ£ŗI-£¾Br-£¬¼ÓČėĀČĘų2.8LŹ±ČÜŅŗÖŠI-amol£¬ŌņĖµĆ÷ĶØČė2.8LCl2Ö»·¢Éś£ŗCl2+2I-ØTI2+2Cl-£¬2.8L±ä³É5.6L£¬ĻūŗÄ2.8L Cl2µÄĪļÖŹµÄĮæĪŖ$\frac{2.8L}{22.4L/mol}$=0.125mol£¬ĻČŗó·¢Éś£ŗCl2+2I-ØTI2+2Cl-£¬Cl2 +2Br-ØTBr2+2Cl-£¬øł¾Ż·“Ó¦·½³ĢŹ½¼ĘĖć£»
¢Ś2.8LĀČĘųµÄĪļÖŹµÄĮæ0.125mol£¬ĶØČė0.125molĀČĘųŹ±ČÜŅŗÖŠÓŠI-£¬ĖłŅŌBr-ƻӊ²Ī¼Ó·“Ó¦£¬ÓÉ“ĖŹéŠ“Ąė×Ó·“Ó¦£»
¢Ū2.8LĀČĘųµÄĪļÖŹµÄĮæ0.125mol£¬ĶØČė0.125molĀČĘųŹ±ČÜŅŗÖŠÓŠI-£¬ĖłŅŌBr-ƻӊ²Ī¼Ó·“Ó¦£¬ĖłŅŌČÜŅŗÖŠn£ØBr-£©=1.5mol£¬ČÜŅŗÖŠĀČĄė×ÓĪŖĶØČėĀČĘųÉś³ÉµÄŗĶŌĄ“ČÜŅŗÖŠ“ęŌŚµÄ£¬øł¾ŻClŌ×ÓŹŲŗć¼ĘĖćŌĄ“n£ØCl-£©£»5.6LĀČĘųµÄĪļÖŹµÄĮæ=$\frac{5.6L}{22.4L/mol}$=0.25mol£¬ĶØČė0.25molĀČĘųŹ±ČÜŅŗ֊ƻӊI-£¬ŌņµāĄė×ÓĶźČ«·“Ó¦£¬ĒŅn£ØBr-£©=1.4mol£¬ĖµĆ÷ÓŠ0.1moläåĄė×Ó²Ī¼Ó·“Ó¦£¬ŌņµāĄė×ÓĶźČ«·“Ó¦£¬øł¾Ż×ŖŅʵē×ÓĻąµČ¼ĘĖćn£ØI-£©£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗĶłøĆČÜŅŗÖŠÖšµĪ¼ÓČėNaOHČÜŅŗ£¬æŖŹ¼²śÉś³ĮµķµÄĪļÖŹµÄĮæĪŖ0£¬¹ŹŅ»¶Øŗ¬ÓŠH+£¬ÄĒĆ“Ņ»¶Ø²»ÄÜŗ¬ÓŠCO32-”¢AlO2-£¬V1-V2¶ĪÉś³É³Įµķ£¬ĒŅ³ĮµķŌŚV3-V4¶ĪČ«²æČܽā£¬¹ŹČÜŅŗÖŠŅ»¶Øŗ¬ÓŠAl3+£¬Ņ»¶Ø²»ÄÜŗ¬ÓŠMg2+”¢Fe2+”¢Fe3+£¬V2-V3¶Ī³öĻÖ³Įµķ²»¼õÉŁ£¬µ«ŹĒĻūŗÄNaOHČÜŅŗ£¬¹ŹŅ»¶Øŗ¬ÓŠNH4+£¬
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬Ņ»¶Ø²»“ęŌŚMg2+”¢Fe2+”¢Fe3+”¢CO32-”¢AlO2-£¬¹Ź“š°øĪŖ£ŗMg2+”¢Fe2+”¢Fe3+”¢CO32-”¢AlO2-£»
£Ø2£©BC¶ĪĄė×Ó·½³ĢŹ½ĪŖNH4++OH-ØTNH3•H2O£¬¹Ź“š°øĪŖ£ŗNH4++OH-ØTNH3•H2O£»
£Ø3£©¢Ł2.8LĀČĘųµÄĪļÖŹµÄĮæĪŖ$\frac{2.8L}{22.4L/mol}$=0.125mol£¬ĶØČė0.125molĀČĘųŹ±ČÜŅŗÖŠÓŠI-£¬ĖłŅŌBr-ƻӊ²Ī¼Ó·“Ó¦£¬ĖłŅŌČÜŅŗÖŠn£ØBr-£©=1.5mol£¬ČÜŅŗÖŠĀČĄė×ÓĪŖĶØČėĀČĘųÉś³ÉµÄŗĶŌĄ“ČÜŅŗÖŠ“ęŌŚµÄ£¬ClŌ×ÓŹŲŗćµĆŌĄ“n£ØCl-£©=1.25mol-0.125mol”Į2=1mol£»ĶØČė0.25molĀČĘųŹ±ČÜŅŗ֊ƻӊI-£¬ŌņµāĄė×ÓĶźČ«·“Ó¦£¬ĒŅn£ØBr-£©=1.4mol£¬ĖµĆ÷ÓŠ0.1moläåĄė×Ó²Ī¼Ó·“Ó¦£¬ŌņµāĄė×ÓĶźČ«·“Ó¦£¬øł¾Ż×ŖŅʵē×ÓĻąµČµĆn£ØI-£©=0.25mol”Į2-0.1mol”Į1=0.4mol£¬øł¾Ż·“Ó¦£ŗCl2+2I-ØTI2+2Cl-£¬øĆ·“Ó¦ÖŠÉś³É0.25molĀČĄė×ÓĻūŗĵāĄė×Ó£¬ĖłŅŌa=0.5mol-0.25mol=0.15mol£¬
¹Ź“š°øĪŖ£ŗ0.15£»
¢Ś2.8LĀČĘųµÄĪļÖŹµÄĮæ0.125mol£¬ĶØČė0.125molĀČĘųŹ±ČÜŅŗÖŠÓŠI-£¬ĖłŅŌBr-ƻӊ²Ī¼Ó·“Ó¦£¬Ö»ÓŠµāĄė×ÓŗĶĀČĘų·“Ó¦£¬ĖłŅŌČÜŅŗÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCl2+2I-=I2+2Cl-£¬¹Ź“š°øĪŖ£ŗCl2+2I-=I2+2Cl-£»
¢ŪĶعżŅŌÉĻ·ÖĪöÖŖ£¬n£ØCl-£©=1mol”¢n£ØBr-£©=1.5mol”¢n£ØI-£©=0.4mol£¬ČÜŅŗĢå»żĻąĶ¬£¬ĘäĪļÖŹµÄĮæÖ®±ČµČÓŚÅضČÖ®±Č£¬ĖłŅŌC£ØCl-£©£ŗC£ØBr-£©£ŗC£ØI-£©=1mol£ŗ1.5mol£ŗ0.4mol=10£ŗ15£ŗ4£¬¹Ź“š°øĪŖ£ŗ10£ŗ15£ŗ4£®
µćĘĄ ±¾Ģāæ¼²éĄė×Ó·“Ó¦·½³ĢŹ½µÄ¼ĘĖć£¬Ć÷Č·Ąė×Ó·“Ó¦ĻČŗóĖ³ŠņŹĒ½ā±¾Ģā¹Ų¼ü£¬½įŗĻ×ŖŅʵē×ÓŹŲŗć”¢Ō×ÓŹŲŗć·ÖĪö½ā“š£¬ĢāÄæÄѶČÖŠµČ£®


 ¾ŁŅ»·“ČżĶ¬²½Ēɽ²¾«Į·ĻµĮŠ“š°ø
¾ŁŅ»·“ČżĶ¬²½Ēɽ²¾«Į·ĻµĮŠ“š°ø æŚĖćÓėÓ¦ÓĆĢāæØĻµĮŠ“š°ø
æŚĖćÓėÓ¦ÓĆĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ČÜŅŗÖŠc£ØH+£©£¾c£ØOH-£© | |
| B£® | NH4+Ė®½āŹĒĪ¢ČõµÄ | |
| C£® | NH3•H2OŹĒČõ¼ī | |
| D£® | ÓÉH2OµēĄė³öµÄc£ØH+£©£¼10-7 mol/L | |
| E£® | ĪļÖŹµÄĮæÅضČĻąµČµÄ°±Ė®ŗĶŃĪĖįµČĢå»ż»ģŗĻ£¬ČÜŅŗpH=7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ÅäÖĘ0.1mol/LµÄNaNO3ČÜŅŗ | B£® |  ¼ģ²é×°ÖĆĘųĆÜŠŌ | ||
| C£® |  ÖĘČ”Fe£ØOH£©2³Įµķ | D£® |  ½ųŠŠÅēČŖŹµŃé |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ²Ł×÷ | ĻÖĻó |
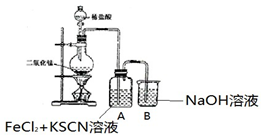 | I£®A ÖŠČÜŅŗ±äŗģ ¢ņ£®ÉŌŗó£¬ČÜŅŗÓÉŗģÉ«±äĪŖ»ĘÉ« |
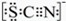
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | æÉŅŌÓĆŠĀÖʵÄĒāŃõ»ÆĶŠü×ĒŅŗ£ØæɼÓČČ£©¼ų±šŅŅ“¼”¢ŅŅĖįŗĶĘĻĢŃĢĒČÜŅŗ | |
| B£® | ²»ŗ¬ĘäĖūŌÓÖŹµÄĢģČ»ÓĶÖ¬ŹōÓŚ“æ¾»Īļ | |
| C£® | Ėæ³ńŗĶĆŽ»ØµÄ×é³ÉŌŖĖŲĻąĶ¬£¬·Ö×Ó½į¹¹²»Ķ¬£¬Ņņ¶ųŠŌÖŹ²»Ķ¬ | |
| D£® | ±½ŗĶŅŅĻ©¶¼ÄÜŹ¹äåĖ®ĶŹÉ«£¬µ«Į½Õß·¢ÉśµÄ»Æѧ·“Ó¦ĄąŠĶ²»Ķ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķ¬Ī»ĖŲ | B£® | Ķ¬ĻµĪļ | C£® | Ķ¬·ÖŅģ¹¹Ģå | D£® | Ķ¬ĖŲŅģŠĪĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com