
| A. | 原子晶体 | B. | 非极性分子型物质 | ||
| C. | 极性分子型物质 | D. | 离子晶体 |
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀含铜印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 将氯气溶氢氧化钠溶液:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 将磁性氧化铁溶于足量稀硝酸:Fe3O4+8H+═2Fe3++Fe2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离出自由移动的Na+和Cl- | |
| B. | 设阿伏加德罗常数为NA,则2.24LCO2气体中所含原子数目为0.3NA | |
| C. | 实验室里将少量金属钠保存在煤油中 | |
| D. | 向某无色溶液中加入少量BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则此溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
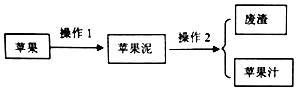
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 1 mol Cu和2mol热的浓硫酸反应可生成NA个SO2分子 | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2molAB吸收b kJ热量 | |
| B. | 该反应热△H=(b-a)kJ•mol-1 | |
| C. | 该反应为吸热反应 | |
| D. | 断裂1 mol A-A和1 mol B-B键放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯的分子数为NA | |
| B. | 48 g O3气体含有NA个O3分子 | |
| C. | 0.5 mol•L-1 CuCl2溶液中含有0.5NA个Cu2+ | |
| D. | 标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com