
(8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11 亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为 。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—
(1)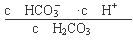 (2)Na2CO3 ;c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
(2)Na2CO3 ;c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
(3)a (4)b
【解析】
试题分析:(1)根据电离平衡常数的含义可得碳酸的第一级电离平衡常数表达式K1=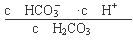 ;(2)酸的电离平衡常数越小,则相应的酸根离子结合H+的能力就越强,由于在相同温度下电离平衡常数最小的碳酸的二级电离K2=5.61×10-11 ,所以在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是Na2CO3;等浓度的Na2CO3和NaHCO3的混合溶液,由于HCO3—、CO32—都会发生水解反应,而且水解程度HCO3—< CO32—,水解是溶液显碱性,c(OH-)>c(H+);但是盐水解的程度是微弱的,主要还是以盐电离产生的离子存在,所以根据物料守恒可得c(Na+)>c(HCO3—)>c(CO32—)。故溶液中各离子浓度大小顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+);(3)若保持温度不变,在醋酸溶液中通入少量HCl,a.CH3COO-会结合形成CH3COOH,所以c(CH3COO-)变小,正确;b.由于加入了H+,所以c(H+)会增大;错误;c.醋酸的电离平衡常数只与温度有关,温度不变,所以电离平衡常数就不变,错误;(4)由于酸性H2CO3>HClO> HCO3— ,所以少量CO2通入次氯酸钠溶液中,会发生反应:CO2+H2O+ClO-=== HCO3—+HClO,正确;b.由于HClO有强氧化性,而H2SO3有还原性,所以少量SO2通入次氯酸钙溶液中,会发生氧化还原反应:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl-,错误;c.过量CO2通入澄清石灰水中,发生反应得到可溶性酸式盐,离子方程式是:CO2+OH-=== HCO3—,正确。
;(2)酸的电离平衡常数越小,则相应的酸根离子结合H+的能力就越强,由于在相同温度下电离平衡常数最小的碳酸的二级电离K2=5.61×10-11 ,所以在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是Na2CO3;等浓度的Na2CO3和NaHCO3的混合溶液,由于HCO3—、CO32—都会发生水解反应,而且水解程度HCO3—< CO32—,水解是溶液显碱性,c(OH-)>c(H+);但是盐水解的程度是微弱的,主要还是以盐电离产生的离子存在,所以根据物料守恒可得c(Na+)>c(HCO3—)>c(CO32—)。故溶液中各离子浓度大小顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+);(3)若保持温度不变,在醋酸溶液中通入少量HCl,a.CH3COO-会结合形成CH3COOH,所以c(CH3COO-)变小,正确;b.由于加入了H+,所以c(H+)会增大;错误;c.醋酸的电离平衡常数只与温度有关,温度不变,所以电离平衡常数就不变,错误;(4)由于酸性H2CO3>HClO> HCO3— ,所以少量CO2通入次氯酸钠溶液中,会发生反应:CO2+H2O+ClO-=== HCO3—+HClO,正确;b.由于HClO有强氧化性,而H2SO3有还原性,所以少量SO2通入次氯酸钙溶液中,会发生氧化还原反应:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl-,错误;c.过量CO2通入澄清石灰水中,发生反应得到可溶性酸式盐,离子方程式是:CO2+OH-=== HCO3—,正确。
考点:考查弱电解质的电离平衡常数的应用、盐的水解、离子浓度大小比较、离子方程式的正误判断的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14。如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-==CuCl。下列说法不正确的是
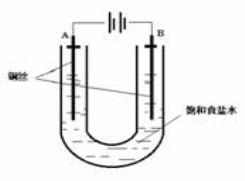
A.B极发生的电极反应为2H++2e- ==H2↑
B.实验开始时,A极附近出现白色浑浊
C.电解时,Na+移向A极
D.一段时间后,U形管底部形成橙黄色沉淀
查看答案和解析>>
科目:高中化学 来源:2014~2015年河北省高一第一学期第一次月考化学试卷(解析版) 题型:填空题
(8分)下列物质中,物质的量最大的是 ,含分子个数最多的是 ,含原子个数最多的是 ,质量最大的是 。(填字母)
A 6g氢气B 0.5mol CO2C 1.204×1024个氯化氢分子 D、147g硫酸
E、92g乙醇(C2H5OH) F、4℃9 mL水
查看答案和解析>>
科目:高中化学 来源:2014~2015年河北省高一第一学期第一次月考化学试卷(解析版) 题型:选择题
黑火药发生爆炸的反应:2KNO3 + S+ 3C = K2S +N2 ↑+ 3CO2↑,被还原的元素是 ( )
A.氮 B.碳 C.氮和碳 D.氮和硫
查看答案和解析>>
科目:高中化学 来源:2014~2015年河北省高一第一学期第一次月考化学试卷(解析版) 题型:选择题
盐是一类常见物质,下列物质可直接反应生成盐的组合是( )
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥ C.只有②⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于
A.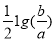 B.
B.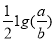 C.14+
C.14+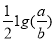 D.14+
D.14+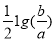
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
已知25 ℃、101 kPa条件下:
(1)4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
(2)4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量高,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:选择题
下述实验不能达到预期实验目的的是( )
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO4·5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com