
分析 (1)2g氢气的物质的量为:$\frac{2g}{2g/mol}$=1mol,根据盖斯定律①-③可得H2O(g)=H2O(l),据此可知1mol水蒸气转化成液态水的反应热;
(2)根据反应②解(1)的计算结果计算出需要燃烧碳的质量.
解答 解:(1)2g氢气的物质的量为:$\frac{2g}{2g/mol}$=1mol,根据盖斯定律①-③可得H2O(g)=H2O(l) (+285.8kJ)-(+241.8kJ)=+44kJ,说明1mol气态水变成液态水需要放出44kJ热量,
故答案为:放出;44;
(2)根据反应C(s)+O2(g)=CO2(g)+393.5kJ可知,提供44kJ热量需要碳的质量为:12g/mol×$\frac{44kJ}{393.5kJ/mol}$≈1.34g,
故答案为:1.34.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意掌握化学反应与能量变化的关系,试题有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷跟氯气发生取代反应 | B. | 乙烯跟氯气发生加成反应 | ||
| C. | 乙烷跟氯化氢混合 | D. | 乙烯跟氯化氢发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 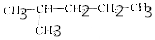 和 和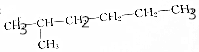 | |
| B. | 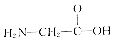 和CH3-CH2-NO2 和CH3-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH和CH3-CH2-CH2-CH2-COOH | |
| D. | CH3-CH2-O-CH2-CH3和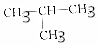 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
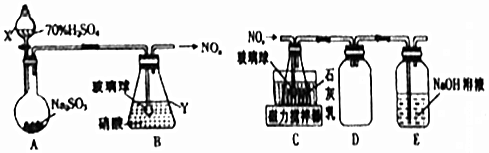
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸溶液中:Fe(OH)3+3HI═Fe3++3I-+3H2O | |
| B. | 少量CO2通入苯酚钠溶液中: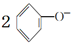 +H2O+CO2→ +H2O+CO2→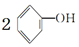 +CO32- +CO32- | |
| C. | 向NaAlO2溶液中通入足量CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| D. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com