
分析 硫酸可与氯化钡反应生成沉淀,盐酸可与硝酸银溶液反应生成氯化银沉淀,以此解答该题.
解答 解:可在3支试管中分别滴加氯化钡溶液,生成白色沉淀的为稀硫酸,发生H2SO4+BaCl2=BaSO4↓+2HCl,另外两支试管分别加热硝酸银溶液,生成白色沉淀的为稀盐酸,发生HCl+AgNO3=AgCl↓+HNO3,
答:在3支试管中分别滴加氯化钡溶液,生成白色沉淀的为稀硫酸,发生H2SO4+BaCl2=BaSO4↓+2HCl,另外两支试管分别加热硝酸银溶液,生成白色沉淀的为稀盐酸,发生HCl+AgNO3=AgCl↓+HNO3.
点评 本题考查物质的检验和鉴别,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质的异同以及实验的设计思路,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
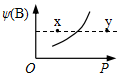 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 mL 1 mol•L-1 FeCl3溶液中含有Fe3+数目小于0.1NA | |
| B. | 1 mol-OH和17 g NH3所含的电子数相等 | |
| C. | 标准状况下,2.24 L Cl2与过量铁粉反应,转移的电子总数为2NA | |
| D. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 2 L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑧ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com