
| A”¢ÉĻŹö·“Ó¦Ė²¼ä²śÉś“óĮæøßĪĀĘųĢåĶĘ¶Æ·É»ś·ÉŠŠ |
| B”¢øĆ·“Ó¦¼ČŹĒŃõ»Æ»¹Ō·“Ó¦Ņ²ŹĒ·Ö½ā·“Ó¦ |
| C”¢ÉĻŹö·“Ó¦¹ż³ĢÖŠ£¬¾É»Æѧ¼ü¶ĻĮŃĖłĪüŹÕµÄÄÜĮæ“óÓŚŠĀ»Æѧ¼üŠĪ³ÉĖłŹĶ·ÅµÄÄÜĮæ |
| D”¢·“Ó¦“ÓÄÜĮæ±ä»ÆÉĻĖµ£¬Ö÷ŅŖŹĒ»ÆѧÄÜ×Ŗ±äĪŖČČÄÜŗĶ¶ÆÄÜ |


 Źī¼Ł×÷ŅµŹī¼ŁæģĄÖĮ·Ī÷°²³ö°ęÉēĻµĮŠ“š°ø
Źī¼Ł×÷ŅµŹī¼ŁæģĄÖĮ·Ī÷°²³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢12ÖÖ | B”¢16ÖÖ |
| C”¢32ÖÖ | D”¢40ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

 ”¢¢ÜHCHOĘäÖŠĢ¼Ō×Ó²ÉČ”sp2ŌӻƵķÖ×ÓÓŠ
”¢¢ÜHCHOĘäÖŠĢ¼Ō×Ó²ÉČ”sp2ŌӻƵķÖ×ÓÓŠ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ÓŠĮ½øöĘšŹ¼Ģå»żĻąĶ¬µÄĆܱÕČŻĘ÷AŗĶB£¬AČŻĘ÷ĪŖ¹Ģ¶ØĢå»ż£»BČŻĘ÷ÓŠŅ»øöæÉŅĘ¶ÆµÄ»īČū£¬ÄÜŹ¹ČŻĘ÷ÄŚ±£³ÖŗćŃ¹£®ĘšŹ¼Ź±ÕāĮ½øöČŻĘ÷·Ö±š³äČėµČĮæµÄSO3ĘųĢ壬²¢Ź¹A”¢BČŻĘ÷ÖŠĘųĢåĢå»żĻąµČ£¬²¢±£³ÖŌŚ400”ęĢõ¼žĻĀ·¢Éś·“Ó¦2SO3?2SO2+O2£¬²¢“ļµ½Ę½ŗā£®
ÓŠĮ½øöĘšŹ¼Ģå»żĻąĶ¬µÄĆܱÕČŻĘ÷AŗĶB£¬AČŻĘ÷ĪŖ¹Ģ¶ØĢå»ż£»BČŻĘ÷ÓŠŅ»øöæÉŅĘ¶ÆµÄ»īČū£¬ÄÜŹ¹ČŻĘ÷ÄŚ±£³ÖŗćŃ¹£®ĘšŹ¼Ź±ÕāĮ½øöČŻĘ÷·Ö±š³äČėµČĮæµÄSO3ĘųĢ壬²¢Ź¹A”¢BČŻĘ÷ÖŠĘųĢåĢå»żĻąµČ£¬²¢±£³ÖŌŚ400”ęĢõ¼žĻĀ·¢Éś·“Ó¦2SO3?2SO2+O2£¬²¢“ļµ½Ę½ŗā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| Ń¹Ēæ/Pa | 2”Į105 | 5”Į105 | 1”Į106 |
| c£ØA£©/mol?L-1 | 0.08 | 0.2 | 0.44 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ĶČÜÓŚFeCl3ČÜŅŗ£ŗCu+Fe3+=Cu2++Fe2+ |
| B”¢NaAlO2ČÜŅŗÖŠĶØČė¹żĮæCO2£ŗ2AlO2-+CO2+3H2O=2Al£ØOH£©3”ż+CO32- |
| C”¢“ĪĀČĖįÄĘČÜŅŗÖŠµĪČėÅØŃĪĖį²śÉśĀČĘų£ŗClO-+Cl-+2H+=Cl2”ü+H2O |
| D”¢Ģ¼ĖįĒāøĘČÜŅŗÖŠ¼ÓČė³ĪĒåŹÆ»ŅĖ®£ŗCa2++2HCO3-+2OH-=CaCO3”ż+CO32-+2H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
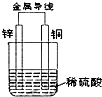 ČēĶ¼ĖłŹ¾£¬½«ŠæʬŗĶĶʬĶعżµ¼ĻßĻąĮ¬£¬ÖĆÓŚĻ”ĮņĖįÖŠ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾£¬½«ŠæʬŗĶĶʬĶعżµ¼ĻßĻąĮ¬£¬ÖĆÓŚĻ”ĮņĖįÖŠ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A”¢Äܽ«µēÄÜ×Ŗ»»ĪŖ»ÆѧÄÜ |
| B”¢ČÜŅŗ»įÖš½„±äĪŖĄ¶É« |
| C”¢ŠæʬŹĒøŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦ |
| D”¢ĶāµēĀ·ÖŠµē×ÓÓÉĶʬ¾µ¼ĻßĮ÷ĻņŠæʬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ČšµäASES¹«Ė¾Éč¼ĘµÄŌųÓĆÓŚĒż¶ÆĒ±Ķ§µÄŅŗ°±-ŅŗŃõČ¼ĮĻµē³ŲŹ¾ŅāĶ¼ČēĶ¼£¬ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ČšµäASES¹«Ė¾Éč¼ĘµÄŌųÓĆÓŚĒż¶ÆĒ±Ķ§µÄŅŗ°±-ŅŗŃõČ¼ĮĻµē³ŲŹ¾ŅāĶ¼ČēĶ¼£¬ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A”¢µē³Ų×Ü·“Ó¦ĪŖ£ŗ4NH3+3O2=2N2+6H2O |
| B”¢µē³Ų¹¤×÷Ź±£¬OH-ĻņÕż¼«ŅĘ¶Æ |
| C”¢µē¼«2·¢ÉśµÄµē¼«·“Ó¦ĪŖ£ŗO2+4H++4e-=2H2O |
| D”¢µēĮ÷Óɵē¼«1¾ĶāµēĀ·Į÷Ļņµē¼«2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
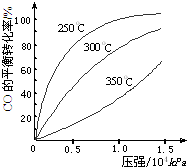 ŃŠ¾æNO2”¢SO2”¢COµČ“óĘųĪŪČ¾ĘųĢåµÄ“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ壮
ŃŠ¾æNO2”¢SO2”¢COµČ“óĘųĪŪČ¾ĘųĢåµÄ“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ壮| “߻ƼĮ |
| ¼ÓČČ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com