
| A. | 最外层电子数为1的原子都为金属元素的原子 | |
| B. | 最外层电子数为8的微粒是稀有气体元素的原子 | |
| C. | 在元素周期表里,元素所在的周期数等于原子核外电子层数 | |
| D. | 在元素周期表里,主族元素所在的族的序数等于原子核外电子数 |
分析 A.最外层电子数为1的原子不一定为金属元素的原子,如H元素;
B.最外层电子数为8的微粒可能为阴离子或阳离子,不一定为稀有气体原子;
C.原子的核外电子层数决定了元素的周期数;
D.主族元素所在的族的序数等于原子最外层电子数.
解答 解:A.多数最外层电子数为1的原子为金属元素的原子,但是有的最外层电子数为1的原子为非金属原子,如H原子,故A错误;
B.最外层电子数为8的微粒不一定稀有气体元素的原子,如镁离子、硫离子等,故B错误;
C.元素的电子层决定元素所在周期,所以在元素周期表里,元素所在的周期数等于原子核外电子层数,故C正确;
D.在元素周期表里,主族元素所在的族的序数等于最外层电子数,不是原子核外电子数,故D错误;
故选C.
点评 本题考查了原子结构与元素周期表的关系,题目难度不大,明确元素周期表结构为解答关键,B为易错点,注意微粒包括阴阳离子,试题有利于提高学生的灵活应用能力.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 核聚变如${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,因为有新微粒生成,所以该变化是化学变化 | |
| B. | 电子层数越多,半径越大 | |
| C. | 共价化合物分子间均存在分子间作用力 | |
| D. | H2O的稳定性大于H2S,是因为水分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
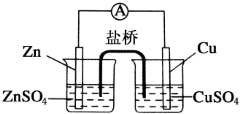 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱:Cl2<S | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H3PO4<H2SO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 Na2SO4 HCl | B. | NaOH NaCl HNO3 | ||
| C. | CuSO4 NaNO3 KOH | D. | Na2CO3 HCl Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
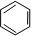 ;一种常见的烃的含氧衍生物:
;一种常见的烃的含氧衍生物: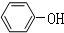 .
.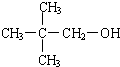 .
.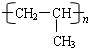 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(OH-) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  配制一定物质的量浓度的稀硫酸 | B. | 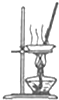 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. | 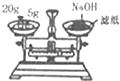 称量NaOH固体 | D. | 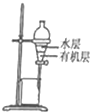 萃取后有机层从下口排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com