
【题目】(1)利用电化学原理,将 NO2、O2 和熔融 KNO3 制成燃料电池,模拟工业电解法来处理含 Cr2O72-废水,如下图所示;电解过程中溶液发生反应: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2 O。
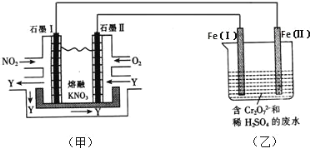
①甲池工作时,NO2 转变成绿色硝化剂 Y,Y 是 N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为______。
②向完全还原为 Cr3+的乙池工业废水中滴加 NaOH 溶液,可将铬以 Cr(OH)3 沉淀的形式除去,已知 Cr(OH)3 存在以下溶解平衡:Cr(OH)(s)![]() Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶度积 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 应调至___________。
Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶度积 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 应调至___________。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行: Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属 Cd 作______极;
②充电时的阳极电极反应式为。_____
③充电时,当电路中通过 0.2moleˉ,阴极质量将___________(填“增加”、“减少”)___________。
【答案】O2+4e-+2N2O5=4NO3- 5 负 Ni(OH)2-e-+ OH-= NiO(OH)+ H2O 减少 3.4g
【解析】
(1) ①甲池为NO2、O2和熔融KNO3组成的燃料电池,由图示知电池工作时通入NO2的一极产生N2O5,氮元素的化合价由+4价升高到+5价,失去电子,故石墨I作负极,所以石墨II作正极;且电解质是熔融KNO3,所以通入O2和N2O5转化为NO3-,则石墨Ⅱ附近发生的电极反应为O2+4e-+2N2O5=4NO3-。
故答案为: O2+4e-+2N2O5=4NO3-;
②要使c(Cr3+)降至10-5molL-1,则此时溶液中c(OH-)= =
=![]() =10-9mol/L,c(H+)=
=10-9mol/L,c(H+)=![]() =
=![]() =10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。
=10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。
故答案为:5;
(2)①放电时,所给式子从左往右看,此时Cd的化合价升高,所以Cd作负极;
故答案为:负;
②充电时,所给式子从右往左看,阳极发生的氧化反应,其对应的电极反应式为:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;
故答案为:Ni(OH)2-e-+OH-= NiO(OH)+ H2O;
③充电时阴极发生反应:Cd(OH)2+2e-=Cd+2OH-,阴极质量要减小,减少的质量即是生成的OH-的质量。此时得电子的物质的量与OH-的物质的量相等,所以生成的OH-的物质的量也是0.2mol,其质量为3.4g。
故答案为:减少;3.4g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是
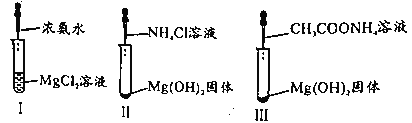
A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A. 当有0.8mol电子转移时,b极产生4.48LO2
B. 为了增加导电性可以将左边容器中的水改为NaOH溶液
C. d极上发生的电极反应是:2H+ +2e-=H2
D. c极上进行氧化反应,A池中的H+可以通过隔膜进入B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如图:

回答下列问题:
(1)步骤Ⅰ制备的Ca2Fe(CN)6易溶于水吗?__(填“易溶”或“不易溶”)。
(2)步骤Ⅲ的化学方程式为__。
(3)步骤Ⅴ所用的试剂X是__(填化学式)。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:

①HCN的电子式为__。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是__,第二步反应的离子方程式为__。
(5)已知蓝色染料普鲁士蓝的合成方法如图:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如图:
![]()
若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请用离子方程式解释检测时试纸变蓝的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
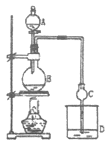
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )

A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,有强还原性。已知:①2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,②H3PO2+NaOH(足量)=NaH2PO2+H2O。下列推断不正确的是
A. H3PO2的结构式为
B. H3PO2具有强还原性,在空气中可能被氧化成磷酸
C. NaH2PO2是酸式盐
D. 每消耗1mol P4,反应①中转移6mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com