
| A. | 氢氧化钡溶液与硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 向Ca(ClO)2溶液中通入少量二氧化硫:Ca2++2ClO-+H2O+SO2═2HClO+CaSO3↓ | |
| C. | 向氯化铁溶液中通入氨气:Fe3++3OH-═Fe(OH)3↓ | |
| D. | 氧化钠与冷水反应:Na2O+H2O═2Na++2OH- |
分析 A.漏掉了镁离子与氢氧根离子生成氢氧化镁的反应;
B.次氯酸能够将亚硫酸钙氧化成硫酸根;
C.氨水为弱碱,一水合氨不能拆开;
D.氧化钠与水反应生成氢氧化钠.
解答 解:A.氢氧化钡与硫酸镁溶液反应的离子方程式为:SO42-+Ba2++Mg2++2OH-=Mg(OH)2↓+BaSO4↓,故A错误;
B.向Ca(ClO)2溶液中通入少量二氧化硫,二者发生氧化还原反应,正确的离子方程式为:Ca2++3ClO-+H2O+SO2═CaSO4↓+2HClO+Cl-,故B错误;
C.一水合氨不能拆开,正确的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故C错误;
D.氧化钠与冷水反应的离子方程式为:Na2O+H2O═2Na++2OH-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 测定常温时的等浓度的HCOONa溶液、CH3COONa溶液的pH | pH(HCOONa)<pH(CH3COONa) | 弱酸的酸性:HCOOH>CH3COOH |
| B | 向0.5ml 2mol/L的NaOH溶液中加入1ml 1mol/L的CuSO4溶液,振荡后再加入0.5ml有机物X,加热 | 未出现砖红色沉淀 | 说明X中不含有醛基 |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
| D | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氧化铝沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 操作和现象(或数据) | 结论 | |
| A | 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,有白色沉淀生成,再加入2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 温度相同时,Fe(OH)3溶解度小于Mg(OH)2 |
| B | 向含有少量氢氧化镁沉淀的试管中滴入NH4Cl溶液,沉淀逐渐溶解,并有刺激性的气味气体产生 | 对应的离子反应方程式为NH4++OH-═NH3↑+H2O- |
| C | 20克Ba(OH)2•8H2O粉末和10克NH4Cl粉末混合后玻璃棒迅速搅拌,可以闻到刺激性气味的气体 | 该反应为放热反应,促使氨水分解生成NH3 |
| D | 常温下,将NaAlO2溶液和NaHCO3溶液混合产生大量白色沉淀 | 说明AlO2-结合H+能力大于CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、沼气属于人类利用的主要化石燃料 | |
| B. | 煤干馏是复杂的物理、化学变化,可得到焦炭、煤焦油和焦炉煤气等 | |
| C. | 氢气是一种清洁能源,其储存、运输都比较方便,故氢气将被人类广泛使用 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氧气反应时特移电子数为2NA | |
| B. | 1molCnH2n+2(n≥2)中含有的C-C键数为(n-1)NA | |
| C. | 0.1mol24Mg32S晶体中所含中子总数为28NA | |
| D. | 标准状况下,11.2LSO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
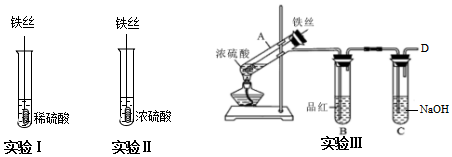
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com