
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去). 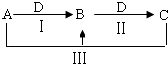
(1)若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是 .
②反应Ⅲ的离子方程式是 .
③氯碱工业制备A的化学方程式是 , 其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是 .
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是 .
②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是 .
【答案】
(1)![]() ;HCO3﹣+OH﹣=H2O+CO32﹣;2NaCl+2H2
;HCO3﹣+OH﹣=H2O+CO32﹣;2NaCl+2H2 ![]() 2NaOH+H2↑+Cl2↑;3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O
2NaOH+H2↑+Cl2↑;3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O
(2)Cl2+2Fe2+=2Cl﹣+2Fe3+;Fe3++3H2O?Fe(OH)3+3H+ , 酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
【解析】解:(1.)氯碱工业的产品为氢氧化钠、氢气和氯气,且A可生成C,C为厨房中用品,A和C反应生成B,A、B、C含有同一种元素,所以A为氢氧化钠,C为碳酸氢钠,B为碳酸钠,D为二氧化碳;①二氧化碳中C的最外层只有四个电子,与氧形成四对共用电子对,达到稳定结构,电子式为: ![]() ;②反应Ⅲ为氢氧化钠和碳酸氢钠反应生成碳酸钠和水,根据离子方程式的书写方法可知该反应的离子方程式为:HCO3﹣+OH﹣=H2O+CO32﹣;③氯碱工业中制备A的化学方程式为:2NaCl+2H2
;②反应Ⅲ为氢氧化钠和碳酸氢钠反应生成碳酸钠和水,根据离子方程式的书写方法可知该反应的离子方程式为:HCO3﹣+OH﹣=H2O+CO32﹣;③氯碱工业中制备A的化学方程式为:2NaCl+2H2 ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
Cl2具有强氧化性,I﹣具有还原性,该反应中消耗0.1mol KI转移电子0.6mol电子,则碘的化合价由﹣1价升高到+5价,碘化钾转化为碘酸钾,氯气做氧化剂,化合价由0价降低到﹣1价,反应的离子方程式为:3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O;
(2.)D为单质且D元素的一种红棕色氧化物常用作颜料,所以D为铁;A为气体单质,与铁反应生成B,B和铁反应生成C,A和铁反应生成B,所以A为氯气,B为氯化铁,C为氯化亚铁;①反应Ⅲ为氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Cl﹣+2Fe3+;②氯化铁为强酸弱碱盐,在水中发生水解Fe3++3H2OFe(OH)3+3H+ , 生成氢氧化铁胶体,可起到净水作用,在酸性条件下,抑制了酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,
不能使酸性废水中的悬浮物沉降除去.
所以答案是:(1.)① ![]() ;②HCO3﹣+OH﹣=H2O+CO32﹣;③2NaCl+2H2
;②HCO3﹣+OH﹣=H2O+CO32﹣;③2NaCl+2H2 ![]() 2NaOH+H2↑+Cl2↑,3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O;
2NaOH+H2↑+Cl2↑,3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O;
(2.)①Cl2+2Fe2+=2Cl﹣+2Fe3+;②Fe3++3H2OFe(OH)3+3H+ , 酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视.过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJmol﹣1)的变化:

(1)关于该反应的下列说法中,正确的是(填字母).
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)= .
②该反应的平衡常数表达式K= .
③下列措施中能使化学平衡向正反应方向移动的是(填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A. 加热B. 滴加少量CuSO4溶液
C. 将铁片改用铁粉D. 增加稀硫酸的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A和B原子都有1个未成对电子,A+比B-少一个电子层。B原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子,其气态氢化物的水溶液的pH在同族氢化物中最大,D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 40%,且其核内质子数等于中子数,据此判断:
(1)A是 , B是 , C是 , D是。(填元素名称)
(2)B-的电子排布式 , A+的结构示意图 , D原子的轨道表示式。
(3)在A、B、D三种元素的简单离子中,半径最小的是 , 其离子还原性最强的是。(填离子符号)
(4)用电子式表示化合物AB的形成过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、 Na+中的一种或几种, 取100mL该溶液,向其中不断滴加某浓度的NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示, 则下列叙述不正确的是( )
A.该溶液中一定不含Fe3+、Cu2+
B.a点到b点,没有发生化学反应
C.所加NaOH溶液物质的量浓度为1mol/L
D.该溶液中一定含有Mg2+、Al3+、NH4+ , 且三者物质的量浓度之比为1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
A.洗气瓶中产生的沉淀是BaCO3
B.在Z导管出来的气体中无CO2
C.洗气瓶中产生的沉淀是BaSO3
D.在Z导管口有红棕色气体出现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com