
分析 (1)据反应热中能量变化=旧键断裂吸收的总能量-新键形成释放的总能量来计算该反应的能量变化,氢气在氧气中燃烧,该反应放热,即旧键断裂吸收的总能量小于新键形成释放的总能量,据此解答;
(2)反应是可逆反应不能进行进行彻底,18O存在于所有含氧物质中.
解答 解:(1)工业生产硫酸过程中存在反应,2SO2(g)+O2(g)?2SO3(g),旧键断裂吸收的总能量为:2Q1KJ+Q2KJ,新键形成释放的总能量为:2Q3KJ;由于该反应放热,旧键断裂吸收的总能量小于新键形成释放的总能量,所以2Q1+Q2<2Q3;
故答案为:2Q1+Q2<2Q3;
(2)因为2SO2+O2?2SO3是可逆反应不能进行彻底,所以反应后18O存在于SO2、O2、SO3中,
故答案为:3.
点评 本题考查了化学平衡的分析判断,抓住可逆反应不能进行进行彻底,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
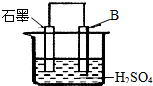 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2CO3固体溶于1L水中配成溶液,其物质的量浓度为1mol/L | |
| B. | 40g NaOH固体溶于100g水,配成的溶液质量百分比浓度为40% | |
| C. | 22.4L氨气溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 1mol NaCl固体溶于水配成1L溶液,其物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从上到下氢化物的熔沸点逐渐升高 | |
| B. | 从上到下单质的还原性逐渐减弱 | |
| C. | 从上到下最高价氧化物的水化物酸性逐渐减弱 | |
| D. | 从上到下原子得电子的能力逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
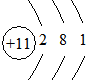 ;
; ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程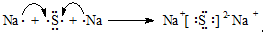 ;
;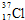 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
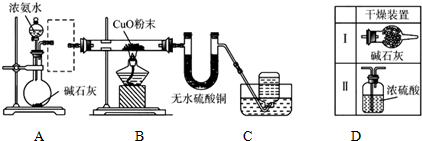
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

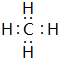 .
. .
.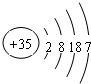 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com