
| A. | X与Y只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的酸性:N>M | |
| C. | 单质与水反应的剧烈程度:Z>Y | |
| D. | 气态氢化物稳定性:M>X |
分析 X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,Z的+2价阳离子电子层结构与氖相同,故Z为Mg元素;Y在同周期主族元素中原子半径最大,则Y处于IA则,由原子序数可知M、N处于第三周期,且族序数Mg<M<N,X、M同主族,则X、M的族序数大于ⅡA族,而Y的原子序数又大于Z、小于Mg,可推知Y为Na;Y和M可以形成Y2M型化合物,则M表现-2价,故M为S元素、X为O元素;N的原子序数大于硫,故N为Cl.
解答 解:X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,Z的+2价阳离子电子层结构与氖相同,故Z为Mg元素;Y在同周期主族元素中原子半径最大,则Y处于IA则,由原子序数可知M、N处于第三周期,且族序数Mg<M<N,X、M同主族,则X、M的族序数大于ⅡA族,而Y的原子序数又大于Z、小于Mg,可推知Y为Na;Y和M可以形成Y2M型化合物,则M表现-2价,故M为S元素、X为O元素;N的原子序数大于硫,故N为Cl.
A.X为O元素,Y为Na元素,二者可以形成Na2O、Na2O2,故A错误;
B.同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性最强,故酸性:高氯酸>硫酸,故B正确;
C.同周期自左而右金属性减弱,故金属性Na>Mg,单质与水反应的剧烈程度:Na>Mg,故C错误;
D.同主族自上而下非金属性减弱,气态氢化物稳定性减弱,故气态氢化物稳定性X>M,故D错误;
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生分析推理能力以及元素周期律,难度中等.


科目:高中化学 来源: 题型:解答题
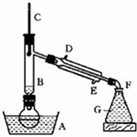 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2 Cu2++2CH3COO-+2H2O | |
| B. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO32- | |
| D. | 甲酸溶液与足量的银氨溶液共热HCOOH+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离汽油和氯化钾溶液的混合液,采用分液的方法 | |
| B. | 除去NaCl溶液中混有的I2,用酒精把NaCl溶液中的I2萃取出来 | |
| C. | 除去02中混有的水蒸气,通过盛有浓硫酸的洗气瓶洗气 | |
| D. | 除去固体碘中混有的少量 Nal.采用加热升华的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、X | B. | X、Y、Z | C. | X、Z、Y | D. | Z、Y、X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是离子化合物 | B. | 它的热稳定性好 | ||
| C. | 它能与强碱发生反应 | D. | 其溶液可与AgNO3溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n(Na+):n(Cl-)可能为7:3 | |
| B. | 与NaOH反应的氯气一定为0.3mol | |
| C. | 当转移电子为n mol时,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为6:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com