
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
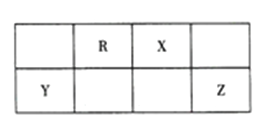
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
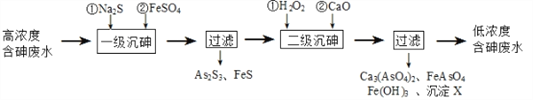
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________;AsH3的电子式为____________;
(2)根据元素周期律,下列说法正确的是_________。
a.酸性:H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As
c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________。
(4)沉淀X为_________________(填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分离与提纯是化学的重点,根据下列实验目的,分别选择相应的实验装置。

(1)除去氯化钠晶体中的碳酸钠______。
(2)除去碳酸钙中的氯化钠______。
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶):______。
(4)从溴水中提取溴______。
(5)除去氧化钙中的碳酸钙______。
(6)分离固体食盐和碘的方法______。
查看答案和解析>>
科目:高中化学 来源: 题型:
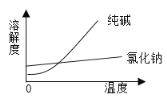
【题目】阅读、分析下列两个材料:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
根据上述材料回答下列问题(填写序号):
A、蒸馏法
B、萃取法
C、结晶法
D、分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来的最佳方法是___________;
(2)将乙二醇和丙三醇相互分离的最佳方法是___________;
(3)分离汽油和水的最佳方法是___________;
(4)从碘水中提取单质碘的最佳方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.75%的酒精可使蛋白质变性,常用于杀菌消毒
B.氨基酸为高分子化合物,分子中含有-COOH和-NH2
C.往淀粉水解液中加入过量NaOH溶液,再加入碘水,未变蓝色,则说明淀粉已完全水解
D.油脂在碱性条件下水解生成高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下)。已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。试计算:
CuSO4+SO2↑+2H2O。试计算:
(1)反应后生成硫酸铜的物质的量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
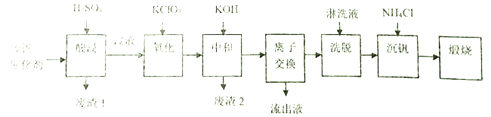
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 键能越大,表示该分子越容易受热分解
B. 共价键都具有方向性
C. 在分子中,两个成键的原子间的距离叫键长
D. H—Cl的键能为431.8 kJ·mol-1,H—Br的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com