
 FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1 2FeO(s) △H3
2FeO(s) △H3| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
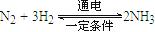 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。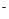 =2NH3) (5)中,大于。
=2NH3) (5)中,大于。 FeO(s)+CO(g)
FeO(s)+CO(g) 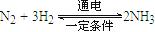 从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为
从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为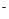 =2NH3 在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01
=2NH3 在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01

科目:高中化学 来源:不详 题型:单选题
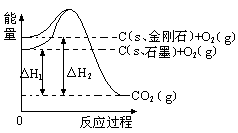
| A.金刚石比石墨稳定性强 |
| B.石墨变为金刚石是物理变化 |
| C.石墨变为金刚石是放热反应 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2O(g) = H2(g)+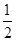 O2(g)△H= +242kJ·mol-1 O2(g)△H= +242kJ·mol-1 |
| B.2H2(g)+O2(g)= 2H2O(l) △H= -484kJ·mol-1 |
C.H2(g)+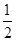 O2(g)=H2O(g) △H= +242kJ·mol-1 O2(g)=H2O(g) △H= +242kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g) △H= +484kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃烧反应一定是放热反应 |
| B.熵减的反应一定不能自发进行 |
| C.能自发进行的反应,反应速率一定很大 |
| D.能自发进行的反应,化学平衡常数一定很大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
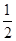 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=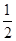 Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )| A.上述热化学方程式中的计量数表示分子个数 | B.△H1>△H2 |
| C.△H2 =" -" 57.3 kJ·mol-1 | D.|△H1|>|△H2| |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2(t-BuNO),测得该反应的ΔH =" +50.5" kJ·mol-1,活化能Ea =" 90.4" kJ·mol-1。能量关系图合理的是
2(t-BuNO),测得该反应的ΔH =" +50.5" kJ·mol-1,活化能Ea =" 90.4" kJ·mol-1。能量关系图合理的是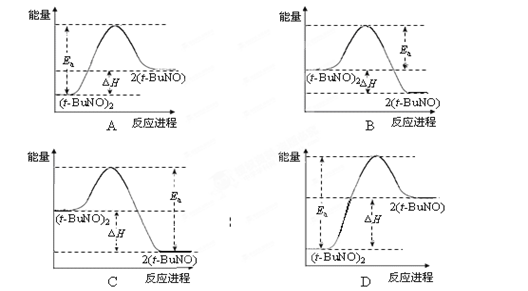
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com