
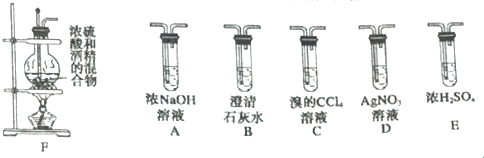
分析 (1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,据此写出反应的化学方程式;浓硫酸密度大于乙醇,稀释放出大量的热;
(2)乙醇在浓硫酸做催化剂作用下发生分之间脱水生成乙醚;
(3)根据实验目的及题干信息,应该先用氢氧化钠溶液除去SO2、CO2,再用澄清石灰水检验杂质是否除尽,然后用浓硫酸干燥乙烯,再用溴的四氯化碳溶液检验乙烯的性质,用D检验是否有溴化氢生成从而判断乙烯与溴的反应类型;
(4)溴与乙烯若发生反应则C中溴水褪色,若发生加成反应,D中无溴离子,不会产生溴化银沉淀,若发生取代反应,则生成溴化氢,溴化氢与硝酸银反应生成溴化银黄色沉淀,据此解答.
解答 解:(1)乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,浓硫酸密度大于乙醇,浓硫酸稀释产生大量的热,稀释浓硫酸应将浓硫酸缓慢注入乙醇中,并用玻璃棒不断搅拌;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;浓硫酸;
(2)乙醇在浓硫酸做催化剂作用下发生分之间脱水生成乙醚,化学方程式:2C2H5OH$→_{140}^{浓硫酸}$ C2H5-O-C2H5+H2O;
故答案为:2C2H5OH$→_{140}^{浓硫酸}$ C2H5-O-C2H5+H2O;
(3)为得到纯净的乙烯,应用NaOH溶液除去SO2、CO2,(并用石灰水检验是否除尽),然后用浓硫酸干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,所以装置连接顺序为:F→A→B→E→C→D,
故答案为:A→B→E→C;
(4)溴与乙烯若发生反应则C中溴水褪色,若发生加成反应,D中无溴离子,不会产生溴化银沉淀,若发生取代反应,则生成溴化氢,溴化氢与硝酸银反应生成溴化银黄色沉淀;
故答案为:溶液褪色;D中无淡黄色沉淀生成.
点评 本题考查了乙烯的实验室制备和性质的检验,明确制备原理是解题关键,注意掌握乙醇的化学性质、乙烯性质及检验方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | W与Y可以形成离子化合物 | |
| B. | X的简单氢化物在同主族元素的氢化物中沸点最高,说明X的非金属性最强 | |
| C. | X和Z形成的原子个数1:1的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z的熔融氧化物来制取Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若E、F、W形成的化合物EFW2,则E与W可以形成化合物E2W2 | |
| B. | F的最高价氧化物对应的水化物一定能与氢氧化钠溶液反应 | |
| C. | 稳定性:Z的氢化物>W的氢化物 | |
| D. | 沸点:Z的氢化物>W的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘水,变蓝色;浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀 | |
| B. | 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色 | |
| C. | 新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 | |
| D. | 碘水,变蓝色;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com