
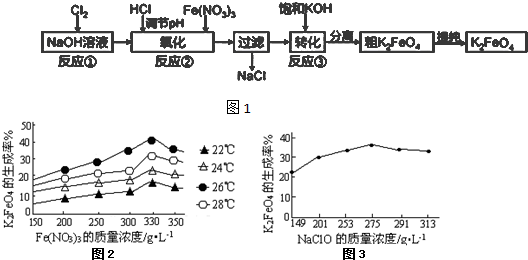
| 330 |
| 275 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、HD、CaCl2、NaOH、HCl四种物质都属于化合物 |
| B、有单质参加或生成的反应一定属于氧化还原反应 |
| C、金属氧化物不一定是碱性氧化物,酸酐不一定是酸性氧化物 |
| D、金属单质只能做还原剂,非金属单质只能做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖能氧化新制氢氧化铜生成红色的氧化亚铜(Cu2O) |
| B、甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 |
| C、羊毛、蚕丝、棉花和麻等天然高分子材料的主要成分都是蛋白质 |
| D、乙酸和甲酸乙酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发时,将蒸发皿放置在铁架台的铁圈上直接用酒精灯外焰加热 |
| B、蒸馏时,温度计水银球浸入圆底烧瓶内液面之下,冷凝水从冷凝管下口进 |
| C、萃取时,分别用两个烧杯从下口接收有机层和水层 |
| D、配制100ml 0.100 mol/L的硫酸铜溶液时,可将2.50克胆矾溶于100mL蒸馏水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| B、用PH试纸测得氯水的PH约为3 |
| C、纯净的H2在Cl2中安静的燃烧,发出苍白色的火焰,集气瓶口有白烟生成 |
| D、氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com