解答:解:【A】A、B、C、D、E、F六种短周期元素,原子序数依次增大.A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍,则A为氧元素,E为硫元素;D元素原子最外层电子数是次外层电子数的一半,D元素的原子序数大于氧元素,则D有3个电子层,故最外层电子数为4,故D为硅元素;B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,则B、C最外层电子数之和为4,原子序数B、C大于氧元素,则B、C两元素不可能为同族元素,最外层电子数为1、3组合,原子序数B小于C,故B为钠元素,C为铝元素;C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数,则F元素原子最外层电子数为3+4=7,故F为氯元素.
故A为氧元素,B为钠元素,C为铝元素,D为硅元素,E为硫元素;F为氯元素.
(1)B为钠元素,F为氯元素,二者形成氯化钠,由钠离子与氯离子构成,用电子式表示氯化钠形成化合物的过程为
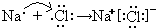
.
故答案为:
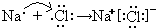
.
(2)A、C两元素的化合物为氧化铝,B的氢氧化物为氢氧化钠,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O.
故答案为:Al
2O
3+2OH
-=2AlO
2-+H
2O.
(3)D为硅元素,F为氯元素,非金属性Si<Cl,非金属性越强,氢化物越稳定,D气态氢化物的稳定性小于E的气态氢化物的稳定性.
故答案为:小于.
【B】A、B、C、D均为短周期不同主族的元素,分别属于三个不同的周期且原子序数依次增大.A与B能形成一种使湿润红石蕊试纸变蓝的气体X,则X为NH
3,所以A为氢元素,B为氮元素;A、C可形成原子个数比分别为1:1和2:1的两种化合物,C为氧元素,A、B、C能形成一种离子化合物为硝酸铵,其水溶液成弱酸性,符合题意;A与D能形成酸性气体Y,元素为不同主族的元素,分别属于三个不同的周期,故D为氯元素.
故A为氢元素,B为氮元素;C为氧元素,D为氯元素;X为NH
3,Y为HCl.
(1)由上述分析可知,D为Cl;X为NH
3,Y为HCl,氨气与氯化氢反应生成氯化铵,反应方程式为NH
3+HCl=NH
4Cl.
故答案为:NH
3+HCl=NH
4Cl.
(2)A为氢元素,B为氮元素;C为氧元素,A、B、C形成的离子化合物为硝酸铵,水溶液呈弱酸性的原因 NH
4++H
2O
NH
3?H
2O+H
+.
故答案为:NH
4++H
2O
NH
3?H
2O+H
+.
(3)D为氯元素,铋(Bi)跟Cl元素能形成化合物(BiCl
3),其水解生成难溶于水的(BiOCl).
①BiCl
3水解生成难溶于水的BiOCl,各元素化合价为变,所以水中氢原子与氯原子结合生成HCl,水解反应的化学方程式为BiCl
3+H
2O
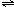
BiOCl+2HCl.
故答案为:BiCl
3+H
2O
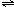
BiOCl+2HCl.
②Y为HCl,BiCl
3水解BiCl
3+H
2O
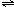
BiOCl+2HCl,生成难溶于水的BiOCl,把适量的BiCl
3溶于含有少量HCl的水中,盐酸抑制BiCl
3水解,得到澄清溶液.
故答案为:盐酸抑制BiCl
3水解.
③BiOCl中的Cl为-1价,不是+1价,这种叫法不合理.
故答案为:不合理;BiOCl中的Cl为-1价,不是+1价.

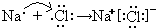
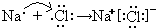
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ BiOCl+2HCl
BiOCl+2HCl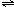 BiOCl+2HCl
BiOCl+2HCl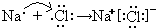 .
.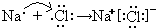 .
.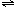 NH3?H2O+H+.
NH3?H2O+H+.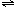 NH3?H2O+H+.
NH3?H2O+H+.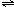 BiOCl+2HCl.
BiOCl+2HCl.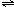 BiOCl+2HCl.
BiOCl+2HCl.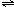 BiOCl+2HCl,生成难溶于水的BiOCl,把适量的BiCl3溶于含有少量HCl的水中,盐酸抑制BiCl3水解,得到澄清溶液.
BiOCl+2HCl,生成难溶于水的BiOCl,把适量的BiCl3溶于含有少量HCl的水中,盐酸抑制BiCl3水解,得到澄清溶液.


