
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2 min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4 min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,到达平衡时n(CO2)<0.60 mol |
分析 A.由表中时间可知,0~2min内CO的物质的量变化量为2mol-0.8mol=1.2mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO)并判断;
B.由表中数据结合方程式可知,0~2min内CO、CO2、SO2的物质的量变化量为2mol-0.8mol=1.2mol,4~6min时,变化了0.4mol,据此分析;
C.计算该温度时反应平衡常数,根据升高温度平衡常数的变化判断平衡移动方向,据此解答;
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为原平衡体积增大一倍,降低压强,平衡向正方向移动,据此分析解答.
解答 解:A.由表中时间可知,0~2min内CO的物质的量变化量为2mol-0.8mol=1.2mol,则v(CO)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3 mol•L-1•min-1,故A错误;
B.由表中数据结合方程式可知,0~2min内CO、CO2、SO2的物质的量变化量为2mol-0.8mol=1.2mol,4~6min时,变化了0.4mol,所以平衡移动的原因可能是向容器中加入了2.0 mol的SO2,故B正确;
C.由表中时间可知,MgSO4(s)+CO(g)$\frac{\underline{\;点燃\;}}{\;}$MgO(s)+CO2(g)+SO2(g)
开始(mol):2 0 0
变化(mol):1.2 1.2 1.2
平衡(mol):0.8 1.2 1.2
故该温度下平衡常数k=$\frac{\frac{1.2}{2}×\frac{1.2}{2}}{\frac{0.8}{2}}$=0.9,若升高温度,反应的平衡常数变为l.00,则平衡向正反应方向移动,所以正反应为吸热反应,故C错误;
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为原平衡体积增大一倍,降低压强,平衡向正方向移动,故到达平衡时n(CO2)>0.60mol,故D错误;
故选B.
点评 本题考查反应速率计算、影响化学平衡因素、化学平衡常数等,难度中等,注意基础知识的积累.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
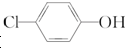 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )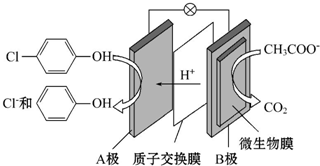
| A. | 该装置能将化学能转化为电能 | |
| B. | A极为正极 | |
| C. | B极上发生氧化反应 | |
| D. | 每有1 mol CH3COO-被氧化,就有8 mol电子通过整个电路 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
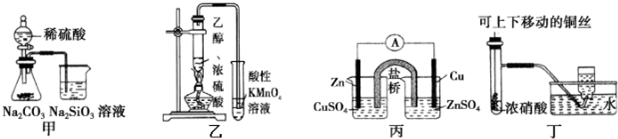
| A. | 图甲证明非金属性强弱:S>C>Si | |
| B. | 装置乙可用于检验有乙烯生成 | |
| C. | 图丙构成铜锌原电池,产生持续稳定的电流 | |
| D. | 图丁可制备并收集NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L 0.1 mol•L-1的FeSO4溶液中含有0.4NA个氧原子 | |
| B. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L | |
| C. | 1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA | |
| D. | 常温下,pH=7的0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 用足量的氨水吸收硫酸工业尾气中的SO2:SO2+NH3•H2O=NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
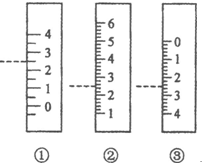 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com