
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )
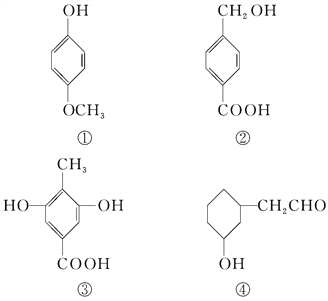
A. ①属于酚类,可与NaHCO3溶液反应产生CO2
B. ②属于酚类,能使FeCl3溶液显紫色
C. 1 mol ③最多能与3 mol Br2发生反应
D. ④属于醇类,可以发生消去反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 molL-1s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 molL-1
其中正确的是
A. ①④ B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 依据事实写出下列反应的热化学方程式。
① 在25℃、101kPa下,1g甲醇CH3OH燃烧生成CO2和液态水时放热22.68kJ。
则表示甲醇燃烧热的热化学方程式为__________________。
② 若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量_____________。
II. 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式
①Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8 kJ.mol -1
②3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ.mol -1
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ.mol -1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式________________。
III.已知反应 2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、 1molI2(g)分子中化学键断裂时分别需要吸收 436KJ、151KJ 的能量,则 1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL (高分子化合物)及阻燃剂四溴双酚。合成线路如下:

已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色
②Y有四种不同化学环境的氢
③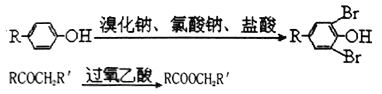
(1)C的官能团名称为_______________,D的结构简式为_________________。
(2)A→B的化学方程式:_________________________________________。
(3)X→Y的化学方程式:_________________________________________。
(4)0.1mol四溴双酚在一定条件下与足量的NaOH溶液反应,最多消耗____________molNaOH。
(5)E也遇FeCl3溶液显紫色,且相对分子质量比X大28,则E的同分异构体有__________种。
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:______________________________________________。
,写出合成该涂料的反应流程图:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子中每个原子接2个单键和1个双键,它与F2发生加成反应,其加成产物为_____;C60的晶体中,每个C60晶胞的质量为_______。(用含NA的式子表示)
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_______。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶休的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为_______,B原子与N原子之间共价键与配价键的数目比为_____,一个晶胞中N 原子数目为_______。
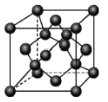
(5)炭与孔雀石共热可以得到金属铜,基态铜原子的电子排布式为_______,铜采用_____堆积,则铜的晶体中Cu 原子的配位数为________。已知铜单质的晶体密度为pg/cm3,Cu的相对原子质量为M,阿伏伽德罗常数NA,则Cu的半径为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中不能大量共存的是
A. SO42-、H+、NO3- Fe3+ B. K+、AlO2-、Cl-、CO32-
C. Na+、Cu2+、S2-、H+ D. Mg2+、SO42-、Cl-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )

A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率 为 25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com