
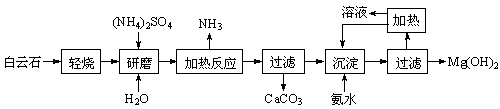
| A.煮沸暂时硬水后,水的硬度一定降低 |
| B.硬水中加入适量石灰水后,由于生成Mg(OH)2、CaCO3沉淀,水就软化了 |
| C.永久硬水主要是由含有Ca2+、Mg2+的硫酸盐和氯化物形成的,加热煮沸是不能软化的 |
| D.如果用HR型离子交换树脂软化硬水,则发生的交换反应可以表示为Ca2++2HR=CaR2+2H+ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。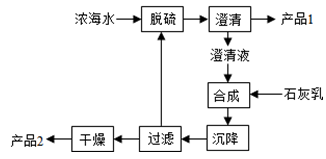

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
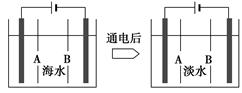
| A.此法对环境不会造成任何污染 |
| B.沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 |
| C.若提取12 kg Mg,则电子转移1 000 mol |
| D.以上提取镁的过程涉及的离子反应共有3个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
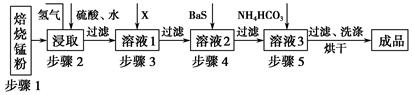
科目:高中化学 来源:不详 题型:单选题
| A.金属的冶炼原理,就是运用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来 |
| B.冶炼金属时,必须加入一种物质作还原剂 |
| C.金属由化合态变为游离态,一定是被还原 |
| D.金属单质被发现和应用的越早,其活动性越弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤②④ | B.②①③④⑤ |
| C.②④①③⑤ | D.③①②⑤④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
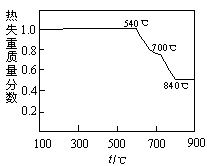
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com