
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
科目:高中化学 来源: 题型:
丙纶的化 学组成是聚丙烯,下列对聚丙烯的描述错误的是
学组成是聚丙烯,下列对聚丙烯的描述错误的是
( )。
A.聚丙烯的分子长链是由C—C键连接而成的
B.聚丙烯的分子长链上有支链
C.聚丙 烯每个链节上有3个碳原子
烯每个链节上有3个碳原子
D.聚丙烯能使溴水退色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
 A.所有碳原子可能在同一平面上 B. 化合物
A.所有碳原子可能在同一平面上 B. 化合物 是苯的同系物
是苯的同系物
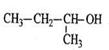
C.的命名为:2-甲基-1-丙醇
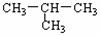 D. 与CH3-CH2-CH2-CH3互为同分异构体
D. 与CH3-CH2-CH2-CH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
有关起居室装修材料的选择,下列说法正确的是 ( )。
A.起居室地面装修以铺瓷砖或天然大理石板为宜
B.塑钢是以聚氯乙烯为基材,以碳酸钙为填充料,用玻璃纤维增强制成的
C.起居室的吊顶用材可选用玻璃板等
D.起居室装修只用大量的涂料和玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-—→4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl-—→Cl2↑+2e-
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
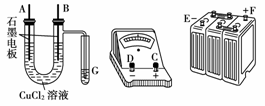
①用电流电解氯化铜溶液,反应仪器如图
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。试回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同)
E接 , 接 , 接F。实验线路中的电流方向为____→____→____→____→____→____。
(2)写出B电极上发生反应的离子方程式__________________________________
________________,G试管中淀粉KI溶液变化的现象为________________,相应的离子方程式是____________________________________________________________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是______________。
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜并称量
⑥再次低温烘干刮下的铜并称量
⑦再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19库仑。试列出阿伏加德罗常数计算表达式:NA=________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应,下列叙述不正确的是( )
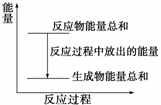
A.反应过程中能量关系可用图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池,锌为负极
D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质分别是( )
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
铜、铬都是用途广泛的金属。工业上利用电镀污泥(主要含有Fe2O3、CuO、
Cr2O3及部分难溶杂质)回收金属铜和铬的流程如下图:

已知:部分物质沉淀的pH如下表:
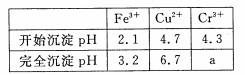
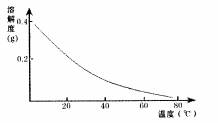
CaSO4的溶解度曲线如右图:
请回答下列问题:
(I滤液I中所含溶质主要有 (填化学式)。
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为____,然后将浊
液加热至80℃ 趁热过滤,所得滤渣Ⅱ的成分为 。
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体。写
出该步骤中发生反应的离子方程式
(4)当离子浓度≤1× 10-5mol· L-1l时,可以认为离子沉淀完全。第④步操作中,若要
使Cr3+完全沉淀,则室温下溶液中a的最小值为 。(已知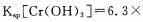
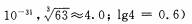
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬。写出铝热法炼铬的化学
方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com