

分析 吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程分析可知,混合气体通入氢氧化钠溶液中吸收二氧化硫,剩余一氧化氮装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,进入装置Ⅲ电解再生Ce4+循环使用,最后剩余的NO3-、NO2-通入氨气和氧气反应得到硝酸铵,
(1)二氧化硫是酸性氧化物,能和强碱之间发生反应;
(2)NaHSO3溶液中HSO3-的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;
(5)根据氧化还原反应中电子守恒来计算.
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,
故答案为:SO2+OH-=HSO3-;
(2)NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,
故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(4)①电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+4H++4e-=S2O32-+3H2O,阳极电极反应为:Ce3+-e-═Ce4+,
故答案为:Ce3+-e-═Ce4+;
②在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,
故答案为:a;
(5)NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:$\frac{1000a}{46}$,设消耗标况下氧气的体积是V,则失电子数目是:$\frac{V}{22.4}$,根据电子守恒:$\frac{1000a}{46}$=$\frac{V}{22.4}$,解得V=243a,
故答案为:243a.
点评 本题综合考查学生含氮元素、含硫元素物质的性质知识,注意知识的梳理和归纳是关键,难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 增大压强可以提高HCl转化率 | |
| D. | 平衡常数K(200℃)<K(400℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物酸性:X>R | |
| B. | 离子半径:Z>W | |
| C. | pH=10的Na2R溶液.由水电离出的c(H+)=10-10mol•L-1 | |
| D. | 气态氢化物稳定性:W>R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
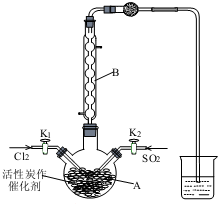 磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.某学习小组用如图装置制备磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).
磺酰氯(SO2Cl2)用于有机合成、医药、染料、农药等,也用作表面活性剂,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.某学习小组用如图装置制备磺酰氯.(已知:SO2(g)+Cl2(g)?SO2Cl2(l)△H<0).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
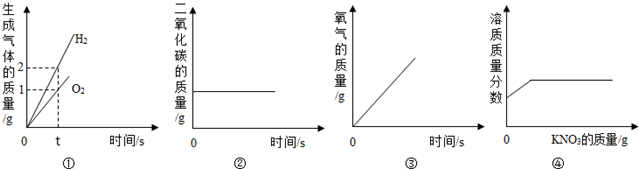
| A. | ①水的电解 | |
| B. | ②木炭在密闭的容器内燃烧 | |
| C. | ③加热一定量的高锰酸钾制氧气 | |
| D. | ④20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com